Balmers Entdeckung der Wasserstoffserie
Die Entdeckung der Wasserstoffserie gelang übrigens auf wundersam unlogische, nämlich ästhetische Weise, wie der Historiker Klaus Hentschel schreibt: »Während in der Standardliteratur zur Vorgeschichte der Quantentheorie Balmers Leistung als glücklicher Erfolg einer algebraisch-pythagoräischen Suchstrategie gewertet wurde, ... behaupte ich, dass Balmers Heuristik sehr viel stärker von visuellen Analogien bestimmt war: Das Wasserstoffspektrum erinnerte mich sofort an perspektivische Verkürzungen (wie zum Beispiel den abnehmenden Abständen zwischen äquidistanten Säulen von der Seite betrachtet). Vor ihm hatten alle ... das Spektrum mit der Brille des Physikers betrachtet. Er betrachtete Spektren ... mit den Augen des darstellenden Geometers. Deshalb erscheint ihm die asymptotische Konvergenz hin zur kürzesten Wellenlänge ... analog dem Fluchtpunkt der Perspektive! Es handelt sich hier um eine Art ›Gestaltzwang‹ in Analogie zu Ludwik Flecks ›Denkzwang‹, der mit jedem Denkstil verbunden ist.«
»Als ich die Balmer-Formel sah, war mir alles klar« – so wird Bohr auf dem Weg zu einem Verstehen des Lichts gern zitiert. »Alles« meint das Modell des Atoms, das unter seinem Namen berühmt geworden ist und die Kunst vielfach – etwa zu einem Atomium – inspiriert hat. In diesem Bohr’schen Atommodell gibt es genau den Kern, auf den Rutherfords Experimente gestoßen waren. Er wird umrundet von Elektronen, denen Bohr nachdrücklich feste Bahnen zuordnete, zwischen denen er ihnen zu springen erlaubt. Wenn die Elektronen nun bei diesen sogenannten Quantensprüngen im Atom von einer Bahn mit viel Energie auf eine Bahn mit weniger Energie wechseln, dann geben sie die Differenz in Form von Strahlen ab, deren Frequenz gemessen und als Linie notiert werden kann.
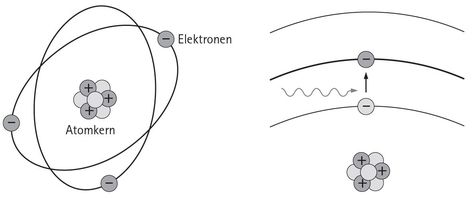
In dem Atommodell von Niels Bohr umkreisen negativ (−) geladene Elektronen einen Kern, in dem es positiv (+) geladene und neutrale Teilchen gibt. Die für uns interessanten Zustände eines Atoms werden durch die Bahnen bestimmt, auf denen die Elektronen unterwegs sind. Die Quantennatur der Atome legt fest, dass zwischen den Bahnen Lücken bestehen, die nur durch Sprünge überwunden werden können.
So populär und einleuchtend diese Konstruktion bis auf den heutigen Tag wirkt, so viele Fragen tauchen auf, wenn man sich ausführlich auf das Modell einlässt und nach den Bedingungen seiner Herkunft und seiner Konzeption fragt. Was hat Bohr anders gemacht als Rutherford? Wie konnte er die Hürden überwinden, an denen sein Kollege gescheitet ist? Und was musste überhaupt in Bohrs Denken passieren, um das Atommodell hervorzubringen?
Was Bohr – neben der Balmer-Serie und den Daten in Form der Spektrallinien – entscheidend half, war der umwälzende Gedanke von Max Planck, den der Berliner Physiker im Jahr 1900 in die Welt der Wissenschaft eingeführt hatte und der heute als Quantensprung populär geworden ist. Planck hatte bemerkt, dass sich das Licht, das schwarze Körper aussenden, wenn sie nach und nach erwärmt und zum leuchtenden Glühen gebracht werden, exakt berechnen und somit im Sinne der Physik verstehen lässt unter der Annahme, dass seine Energie nicht kontinuierlich fließt, sondern in kleinen diskreten »Päckchen« daherkommt. Was von Planck zunächst nur als mathematische Hilfsgröße gedacht war und in seinen Augen keine physikalische Bedeutung bekommen sollte, wandelte Bohr ein Dutzend Jahre später völlig um. Er gab Plancks Quanten ihre unentbehrliche physikalische Wirklichkeit und deutete sie als real existierende Qualität von Atomen. Diese Grundformen der Materie geben Licht – genauer: Lichtenergie – in exakt der Quantenform ab, die Planck eingeführt hatte. Und sosehr Planck unter seiner eigenen Leistung litt und sogar das Wort »Verzweiflung« dafür bemühte, so sehr freute sich Bohr über das Zaubermittel, das ihm mit den spontanen Quantensprüngen zur Verfügung stand. Mit ihrer Hilfe konnte er die Balmer-Serie ableiten und verstehen.
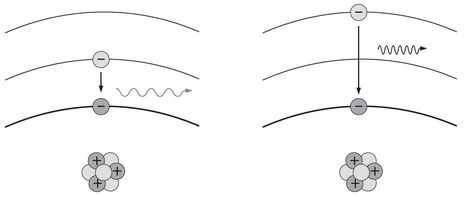
Ein Atom im Grundzustand kann keine Energie freigeben, wohl aber aufnehmen, um in einen angeregten Zustand zu kommen, von dem es dann durch einen Quantensprung wieder in die Ausgangslage zurückkehren kann. Dabei wird Licht ausgesendet, dessen Energie nur diskrete Werte annehmen kann, die in Linien – wie im Wasserstoffspektrum – sichtbar werden.
Quantensprünge sind im Wortsinn Sprünge, und damit widersprach ihre Existenz der Forderung, die der Philosoph und Universalgelehrte Gottfried Wilhelm Leibniz im 18. Jahrhundert zum Ausdruck gebracht hatte, als er schrieb: »Die Natur macht keine Sprünge.« Die Natur sollte stetig, kontinuierlich und durchgängig definiert sein und an keiner Stelle so etwas wie Leere oder gar ein Nichts enthalten. Genau diese Idee verletzen die Quantensprünge aber, die in Bohrs Atom ihre physikalische Aufgabe bekommen, ohne selbst physikalisch fassbar zu sein. Sie finden einfach statt, sie benötigen weder Grund noch Zeit, und da alles in einem Atom passiert, nehmen sie auch kaum irgendwelchen Raum ein. Jede Erkenntnistheorie muss ihre Probleme mit den Quanten haben, was Philosophen dazu brachte, entweder zu verzweifeln oder wegzusehen. Was ein Quantensprung tatsächlich ist oder als Möglichkeit liefert, bleibt noch zu klären. Er ist auf keinen Fall das, was in heutigen Reden aus ihm gemacht wird, etwa wenn Manager fordern, ihr Unternehmen müsse einen Quantensprung machen, und zwar einen großen, und außerdem nach vorn. Die echten Quantensprünge der Natur sind völlig anders. Sie sind das Kleinste, was die Welt neben dem Nichts anbietet, sie gehen meist nach unten und lassen das, was gesprungen ist, in einem Grundzustand zurück, in dem Ruhe herrscht und nichts weiter passiert. Unternehmen, denen solche Quantensprünge gelingen, gehen pleite. Die Atome bleiben dabei gelassen.
Bohr selbst war also »alles klar«, während die anderen Physiker sich immer noch in den Widersprüchen und Ungereimtheiten verfingen, die nach wie vor zwischen Rutherfords Versuchsergebnissen und den Gesetzen der klassischen Physik bestanden. Der Grund für Bohrs Gelassenheit in dem ganzen Durcheinander liegt in seiner bereits angesprochenen souveränen Bereitschaft, scheinbar Unvereinbares zusammen zu denken und die Anfänge von Erklärungen unerklärt zu lassen – also nicht logisch, sondern schöpferisch tätig zu sein. Überhaupt machte es Bohr nichts aus, vieles unverstanden und rätselhaft zu belassen, schließlich gehört dies zu einer guten Wissenschaft, auch wenn es gern von ihren Theoretikern übersehen oder gar verschwiegen wird. Darüber hinaus zeigt sich hierin, dass Bohr – sicher unbewusst – den Standpunkt der Romantiker akzeptierte und nutzte: Wenn er die Elektronen von einer Bahn auf eine andere springen lässt, kann er weder angeben, warum sie so agieren, noch wie sie dabei im mechanischen Detail vorgehen. Er lässt den eigentlichen Übergang im Unklaren.
Man kann diesen historischen Befund auch anders ausdrücken: In dem Bohr’schen Modell des Atoms stecken zwar viele irrationale Gegebenheiten, aber durch ihre unersetzliche Präsenz wird erkennbar, wie Menschen zur Einsicht in Gebilde wie Atome kommen, die ihrer Wahrnehmung entzogen und für sie unsichtbar bleiben. Man begreift sie und ihre Wirklichkeit in dem Augenblick, in dem man das logisch-rationale Gerüst der klassischen Physik um kreativ-irrationale Elemente bereichert und durch die geeignete Kombination aus diesen widersprüchlichen Elementen ein tragbares Gesamtbild entwirft. Bohr billigt zum einen der Natur zu, eine Tendenz zur Formenbildung zu haben, zum anderen erlaubt er dem verstehen wollenden Menschen, seinem Gegenstand ebenfalls eine entsprechende Form – »im allgemeinsten Sinn« (Bohr) – zu geben. Es ist die Gestalt, die Einbeziehung der Morphogenese, die den historischen Rang seines Entwurfs ausmacht und mit der er sein Modell der Materie vorstellt, um die Qualität des entworfenen Atoms mit den Quantitäten der Daten abzusichern.
Wenn hier von Irrationalität die Rede ist, dann geht es um Bausteine der Theorie oder des Modells, für die keine rationale Quelle angegeben werden kann, wie Bohr eingeräumt hat. Dazu gehören das Quantum, das Planck eingeführt hat, die Balmer-Formel, die der Schweizer Mathematiker mehr als Künstler angegangen ist und weniger als Logiker abgeleitet hat, sowie die unerschütterliche Überzeugung Bohrs, dass Rutherfords Modell mit seinem Kern etwas mit der physikalischen Wirklichkeit zu tun hat, die einen Akt des Vertrauens darstellt und nicht alle experimentellen Details benötigte. Was Bohr 1912/13 in Manchester unternahm und den ersten Zugriff des wissenschaftlichen Denkens auf die Atome erlaubte, kann man somit als Kombination aus den beiden großen Traditionen von Aufklärung und Romantik deuten und dadurch kulturhistorisch einordnen: Bohr akzeptierte die etablierte Universalität der höchst rationalen klassischen Physik und berechnete mit ihrer Hilfe die möglichen Bahnen, auf denen sich Elektronen in einem Atom bewegen können. Als ein von überraschenden Forschungsergebnissen begeisterter Mensch erkannte er darüber hinaus die überzeugende Gültigkeit eines individuellen Experiments und damit die Existenz eines Kerns. Zudem fügte er in die systematische Ordnung der Wissenschaft ein irrationales und völlig unverstandenes Element – das Quantum der Wirkung – ein, um mit seiner Hilfe die in ihrer mathematischen Form extrem vernünftig wirkende und zugleich erstaunlich bleibende Balmer-Serie und damit das atomare Verhalten überhaupt zu erklären.
Der Mut, das Einzelne mit dem Universellen, das Kreative mit dem Sorgfältigen, das längst Abgeleitete mit dem glücklich Vorgefundenen und das Sprunghafte mit dem Konstanten – kurzum: das Aufgeklärte mit dem Romantischen – zu verbinden, wurde nun unmittelbar belohnt. Die Einführung des unbegreiflichen Quantums lieferte Bohr eine Möglichkeit, die Stabilität der Atome – und damit der Materie überhaupt – zu erklären. Zwar verlangt die Physik, dass beschleunigte Ladungen in elektrischen Feldern Energie abstrahlen, aber dieser Verlust geht nur nach den Vorgaben der Rationalität stetig vor sich, und genau an dieser Stelle mischt sich die irrationale Existenz des Quantums ein und verhindert den Kollaps der Form. Ein Elektron kann nur dann seine Bahn aufgeben und ändern, wenn es das von Planck eingeführte »Päckchen« verliert – und wie soll es dazu kommen, wenn das Atom in Ruhe gelassen wird und es sich keiner Störung von außen erwehren muss? Mit anderen Worten: Es ist das verrückte Quantum, das die Welt im Innersten zusammenhält. Bohr verstand damit, was Goethes Faust verstehen wollte. Er verstand dabei aber auch, dass dieses Verstehen von uns Menschen erst verstanden werden muss.