Das Licht der Atome
Das Licht, das Atome aussenden, war seit Längerem immer genauer untersucht worden. Dabei hatte sich gezeigt, dass einzelne Atomsorten – zum Beispiel Wasserstoff – kein diffuses, sondern scharf bemessenes Licht abstrahlen, das sich durch die sogenannten Spektrallinien kennzeichnen ließ. Jede Linie repräsentiert das Licht einer bestimmten und genau messbaren Wellenlänge, was auch bedeutet, dass das Licht einer Spektrallinie über eine ebenso genau berechenbare Energie verfügt.
Nun war es dem Schweizer Mathematiker Johann Jakob Balmer 1885 gelungen, für die Reihe der Linien, die sich bei Wasserstoffatomen beobachten lassen, eine einfache Rechenvorschrift anzugeben. Die Wissenschaft spricht von der Balmer-Serie, die das geübte Auge klar erkennen lässt, dass sich die Energie des von einem Atom ausgestrahlten Lichts als Differenz ergibt.
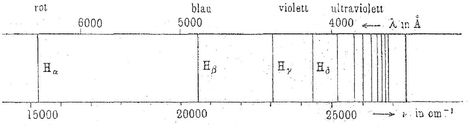
Die verschiedenen Linien des Wasserstoffspektrums, die von den Physikern mit griechischen Indizes versehen wurden. Es fällt auf, dass die Abstände mit abnehmender Wellenlänge enger werden. Hierfür entwickelte der Schweizer Mathematiker Johann Jakob Balmer eine Formel, die mit Bohrs Atommodell triumphal erklärt werden konnte.