Das Periodensystem
Die Vorgaben zu den Einsichten Niels Bohrs stammen aus dem 19. Jahrhundert, seit 1869 kennt die Chemie das Periodensystem der Elemente, das heute in allen naturwissenschaftlichen Hörsälen verwendet wird. Die ersten Entwürfe eines solchen Systems sind vor allem den Vorschlägen und Anregungen des russischen Chemieprofessors Dmitri Mendelejew (1834–1907) zu verdanken – er erzählte, dass er die Ordnung der Dinge zuerst in einem Traum gesehen hatte.
Mendelejew reagierte zusammen mit seinem deutschen Kollegen Lothar Meyer (1830–1895) auf die Entwicklung seiner Wissenschaft, die Historiker als »demographische Explosion« der Elemente bezeichnet haben. Vor 1700 kannten die Chemiker etwa zehn Stoffe, die als elementar – mithin als Elemente – betrachtet werden konnten, unter anderem Gold und Silber, Schwefel und Kupfer, Blei, Eisen und Kohlenstoff. Im 18. Jahrhundert kamen etwas mehr als zwanzig »einfache Körper« hinzu, wie es damals hieß – die Gase Stickstoff, Wasserstoff und Sauerstoff zum Beispiel, darüber hinaus so bekannte Elemente wie Mangan, Nickel und Platin und auch eher wenig vertraute Stoffe wie Strontium, Tellur und Zirkonium. Im 19. Jahrhundert erhöhte sich die Zahl um knapp fünfzig, zu den neuen gehörten neben bekannten Elementen wie Helium und Radium auch Gadolinium und Ruthenium.
Mit der stetig zunehmenden Menge an natürlichen Grundstoffen erhöhte sich die Dringlichkeit der Frage, ob in der vorgefundenen Vielfalt ein System oder eine Ordnung zu erkennen sei. Im Jahr 1869 wurde Mendelejew und Meyer klar, dass dies mithilfe von sogenannten Atomgewichten gelingen kann. Wenn sie die ihnen bekannten Elemente in der Reihenfolge ihres Atomgewichts anordneten, dann wiederholten sich deren chemische Eigenschaften in periodischen Abständen, was es erst zu nutzen und dann zu begreifen galt.
Von »Atomgewicht« sprachen die Chemiker seit dem Beginn des 19. Jahrhunderts, nachdem dem Briten John Dalton aufgefallen war, dass er die Verbindungen, auf die sich Elemente einließen, am besten erklären konnte, wenn er annahm, dass sie aus Grundbausteinen (Atomen) bestanden, die verschieden groß oder schwer waren. Dalton und seinen Nachfolgern gelang damit etwas Großartiges: Sie verwandelten abstrakte Ideen über unteilbare letzte Gebilde – Atome – in konkrete Bausteine der chemischen Elemente und sprachen von nun an gezielt und direkt etwa von Wasserstoff- und Goldatomen.
In den folgenden Jahren ordneten die Chemiker diesen elementaren Atomen Massen oder Gewichte zu, die sich relativ zueinander bestimmen ließen. Als kleinstes Atom – als Atom mit der minimalen Masse oder dem geringsten Gewicht – identifizierte Dalton den Wasserstoff, dem er willkürlich das Atomgewicht 1 zuordnete. Nach geeigneten Messungen konnte er dann etwa von Gold sagen, dass sein Atomgewicht bei 79 liege, da es um diesen Faktor schwerer war. Anfangs nahmen die Chemiker noch an, die schweren Elemente bildeten sich dadurch, dass sich der leichte Wasserstoff mehrfach zusammenballte – beim Gold demnach 79-mal –, aber niemand wusste zu sagen, wie die Natur dies bewerkstelligen konnte oder dabei vorgehen würde.
Unabhängig davon hatte Dalton mit seinen atomaren Vorleistungen der chemischen Wissenschaft eine umfangreiche Aufgabe gestellt, die es schwungvoll in Angriff zu nehmen galt: die Atomgewichte aller anderen bekannten Elemente in Relation zum Wasserstoff zu ermitteln. In den nachfolgenden Jahrzehnten ist dies in erstaunlichem Umfang und äußerst präzise geschehen und hat uns letztlich das Periodensystem in seiner heute bekannten Form beschert.
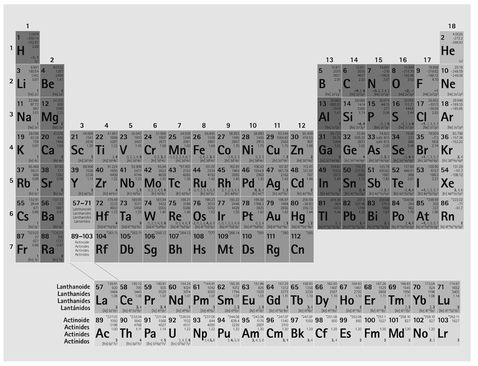
Das Periodensystem der Elemente
Als Mendelejew und Meyer sich der zu ihren Lebzeiten wachsenden Zahl bekannter Elemente mit ihren verschiedenen Atomgewichten zuwandten, bemerkten sie, dass sie damit eine Reihe mit steigenden Zahlen bilden konnten, die sich aber nicht nur linear fortsetzte, sondern sich, bedingt durch die chemischen Eigenschaften der Grundstoffe, periodisch fassen ließ. So gibt es eine Gruppe von Elementen, die auf verwandte Weise reagieren und die man deshalb als Leicht- oder als Alkalimetalle bezeichnet. Es handelt sich dabei um weiche Feststoffe, die sich mit einem Messer durchschneiden lassen; ihr Name leitet sich von dem arabischen Wort »al-qalya« für »Pottasche« ab, die alte Bezeichnung für aus Pflanzenaschen gewonnenes Kaliumcarbonat (diese hat sich bis heute im englischen »Potassium« für Kalium, eines der Alkalimetalle, gehalten). Zu den bekannten Leichtmetallen zählen neben Kalium auch Lithium, Natrium, Rubidium und Cäsium. Jedem dieser Stoffe folgte in der von Mendelejew und Meyer aufgestellten Reihe ein Element, das zur Gruppe der sogenannten Erdalkalimetalle gerechnet wurde. Hierzu zählen Beryllium, Magnesium, Calcium, Strontium und Barium, die sich ebenfalls chemisch bestens vergleichbar verhalten und demnach zusammenhängen.
Beim Betrachten der zahlreichen Befunde kamen Mendelejew und Meyer auf die Idee, die bekannten Elemente sowohl in Reihen als auch in Spalten anzuordnen. Als das Periodensystem allmählich erkennbar wurde, kamen jedoch auch viele Schwierigkeiten ans Tageslicht, die nach einer Erklärung verlangten. Zum einen waren die einzelnen Perioden verschieden lang, und zwischen ihnen lagen Elemente, die nur wenig Verwandtschaft zeigten. Die »Seltenen Erden« (Lanthanoide) passten nirgendwohin, und an einigen Stellen schien die Grundlage der Anordnung gestört. Jod und Tellur zum Beispiel oder Kobalt und Nickel mussten ihrem chemischen Charakter nach entgegen ihrem Atomgewicht eingestuft werden. Dies rief die grundsätzliche Frage hervor, ob es wirklich das Atomgewicht sei, mit dem das System sich fassen ließe. Vielleicht musste man eine andere Ordnungszahl finden, die das System bedingte. Und wer erklärte, warum die Periodenlängen gerade als das Doppelte von Quadratzahlen auftreten, als 2, 8, 18, 32? Hier musste es einen physikalischen Zusammenhang geben, den es zu suchen und zu finden galt – weniger mittels der Logik eines korrekten Systematikers und mehr mit der Kreativität eines verrückten Künstlers, wie Niels Bohr es im Herzen war.
Es war eine Sternstunde der Wissenschaft, als das Periodensystem aus der Taufe gehoben wurde, und Mendelejew war von seiner gelungenen Einsicht in die Ordnung der Dinge derart begeistert, dass er sich zu einem großen Bekenntnis aufschwang (mit »Individuen« meinte er die Elemente, die er erforschte):
Kant glaubte, es existierten im Universum zwei Dinge, die im Menschen Bewunderung und Ehrfurcht wecken: »der bestirnte Himmel über uns und das moralische Gesetz in uns«. Mit der Ergründung der Natur der Elemente und des Periodengesetzes muss ihnen ein drittes hinzugefügt werden: »die Natur der elementaren Individuen, die sich um uns herum äußert«, insofern wir uns ohne diese Individuen keine Vorstellung vom bestirnten Himmel machen könnten, während der Atombegriff die Einzigartigkeit der Individualitäten, die unendliche Wiederholung der Individuen und zugleich ihre Unterordnung unter die harmonische Ordnung der Natur erweist. (siehe Literaturhinweise, Serres)
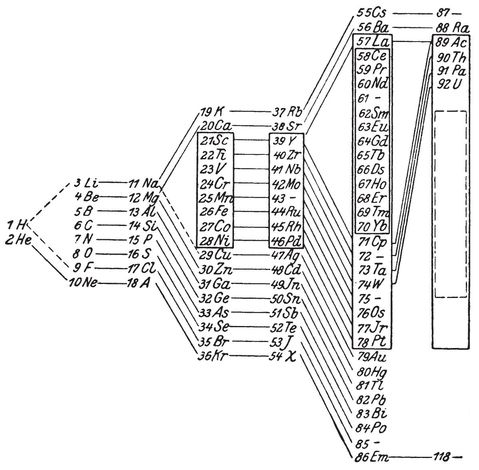
Das periodische System der Elemente in der Version des späten 19. Jahrhunderts, das Niels Bohr als Student lange Jahre vor Augen hatte