41 Niños de diseño
Durante una época, Debbie Edwards pensó que nunca tendría hijos. Su sobrino padecía adrenoleucodistrofia, y en una prueba genética se había demostrado que ella misma era portadora, en uno de sus dos cromosomas X, de la mutación responsable de la enfermedad. Dado que era mujer y, por tanto, poseía un segundo cromosoma X en el que había una copia del gen que funcionaba perfectamente, la señora Edwards no presentaba ningún síntoma de la enfermedad. Sin embargo, cada hijo que concibiera tendría una probabilidad del 50% de desarrollar esta patología cerebral progresiva que causa la muerte a edades tempranas.
Sin embargo, el 15 de julio de 1990, la señora Edwards dio a luz a dos niñas gemelas, Natalie y Danielle. No es que hubiera cambiado de opinión respecto a los peligros de la adrenoleucodistrofia: la ciencia había encontrado una forma de prevenirla.
El equipo del Hammersmith Hospital de Londres, dirigido por Alan Handyside y Robert Winston, creó los embriones mediante fecundación in vitro (FIV) y, después, los desarrolló en el laboratorio hasta la etapa de ocho células. De cada embrión se extrajo una célula y, así, los científicos pudieron evaluar los cromosomas sexuales para determinar cuáles eran de sexo masculino y cuáles de sexo femenino. Dado que la adrenoleucodistrofia es una enfermedad ligada al cromosoma X y que, por tanto, se manifiesta fenotípicamente sólo en los hombres, en el útero de la señora Edwards únicamente se implantaron embriones de sexo femenino.
Este procedimiento se denomina diagnóstico genético preimplantacional (DGPI), y las gemelas Natalie y Danielle fueron los primeros ejemplos de lo que los medios de comunicación denominaron «niños de diseño».
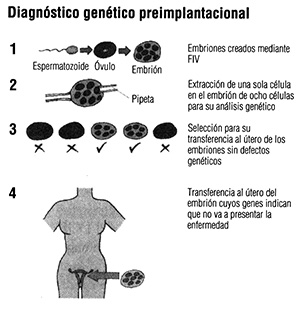
La revolución del DGPI En realidad, no han sido diseñados. Su ADN no se ha modificado, pero el término fue bien aceptado debido a que este método de DGPI permite a los padres hacer lo que nunca antes había sido posible: elegir a sus hijos en función de las características genéticas que poseen o que no poseen.
En las primeras épocas, el DGPI sólo tenía la sensibilidad suficiente para prevenir enfermedades ligadas al cromosoma X, como la hemofilia o la distrofia muscular de Duchenne, mediante la determinación del sexo del embrión; sin embargo, al poco tiempo fue posible evaluar también diversas enfermedades de transmisión autosómica como la fibrosis quística y la enfermedad de Huntington. En la actualidad, es posible detectar más de 200 enfermedades, y en todo el mundo ya han nacido varios miles de niños mediante métodos de DGPI.
Evaluación genética preimplantacional
La técnica de la biopsia del embrión también tiene aplicaciones en el tratamiento de la infertilidad, ya que permite estudiar las características genéticas de los embriones con vistas a incrementar las posibilidades de que el embarazo llegue a término. La mayor parte de los embriones portadores de un número excesivo o insuficiente de cromosomas finaliza en aborto, de manera que esta prueba se puede utilizar para separarlos y transferir al útero solamente los embriones con un número normal de cromosomas.
En Reino Unido hay ocho clínicas que han recibido autorización para llevar a cabo este tipo de evaluación genética preimplantacional en las mujeres con antecedentes de abortos repetidos o de fracaso de la FIV, a pesar de que se mantiene la controversia respecto a los buenos resultados que se pueden obtener con este método. En un estudio efectuado en Holanda en 2007, se señaló que el DGPI podría reducir las tasas de buenos resultados logrados con la FIV debido a que la biopsia podría lesionar también al embrión. Sin embargo, los defensores del DGPI señalan que en este trabajo hubo problemas metodológicos y argumentan que, cuando la técnica se realiza correctamente, es de gran utilidad en algunas mujeres.
Cromosomas artificiales
El DGPI solamente permite seleccionar embriones con perfiles genéticos heredados de sus progenitores, pero, si se aplicaran técnicas avanzadas de ingeniería genética, podría ser que los auténticos «niños de diseño» fueran realidad. Si llegara a suceder, una de las posibilidades sería utilizar cromosomas sintéticos, es decir, estructuras cromosómicas manipuladas mediante ingeniería genética para alojar genes beneficiosos que se podrían introducir en los núcleos de las células que constituyen los embriones de fase temprana.
Posiblemente tendrán que pasar decenios antes de que esta estrategia sea factible, pero si se llevara a cabo podría tener dos ventajas. Por un lado, no interrumpiría la secuencia genética de los cromosomas ya existentes, lo que reduciría el riesgo de introducción de un error que pudiera dar lugar a una enfermedad como el cáncer. Por otra parte, el biofísico Gregory Stock (defensor de las técnicas de ingeniería genética) ha propuesto que sería posible activar los cromosomas artificiales en fechas posteriores, de manera que los niños que los recibieran podrían accionar las modificaciones genéticas tras alcanzar la edad adulta.
Sin embargo, esta técnica ha generado una controversia ética. Las personas que se oponen consideran que el DGPI es inmoral debido a que los embriones portadores de mutaciones genéticas se destruyen o se donan para la investigación médica. Especialmente conflictiva ha sido la aplicación del DGPI a genes como BRCA1. Las mutaciones en este gen incrementan el riesgo de cáncer de mama, pero no indican necesariamente que vaya a aparecer; además, las mujeres que heredan estas mutaciones se pueden proteger del cáncer mamario, si bien mediante un método tan traumático como es la mastectomía preventiva. Los críticos del DGPI consideran que la evaluación de los embriones es una forma de eugenesia.
El DGPI también ha representado una especie de salvavidas para los niños que sufren enfermedades como las leucemias y las anemias, y que necesitan un trasplante celular procedente de un donante genéticamente compatible. En los casos en los que no existe este tipo de donante, los padres pueden intentar tener otro hijo con aplicación del DGPI para detectar cuáles son los embriones con las características más adecuadas para convertirse en donantes. En 2002, una niña norteamericana llamada Molly Nash y que sufre anemia de Fanconi se convirtió en la primera paciente tratada mediante el trasplante de células procedentes de un «hermano salvador». La niña recibió células del cordón umbilical de su hermano recién nacido, Adam, cuyas características tisulares habían sido seleccionadas durante su fase de desarrollo embrionario.
Esta ampliación de los objetivos del DGPI ha generado otra preocupación adicional. El proceso de biopsia que se lleva a cabo en el embrión en el contexto del DGPI conlleva cierto riesgo; si bien es muy pequeño, algunas personas consideran que es un error asumirlo cuando el embrión no va a obtener ningún beneficio directo.
«Todos nos encontramos en un terreno resbaladizo. La pregunta que deberíamos hacernos es: ¿vamos a utilizar esquíes o crampones?»
John Harris, profesor de bioética, Universidad de Manchester
¿Un terreno resbaladizo? Otra objeción que se ha hecho al DGPI se apoya en un argumento distinto: a pesar de que es fácil identificarse con las familias que desean evitar que su hijo padezca una enfermedad grave, o que buscan un donante para un hijo enfermo, esta cuestión establece un precedente alarmante. Se ha señalado que, si se permiten incluso estas aplicaciones que parecen tan evidentes, la sociedad va a entrar en un terreno resbaladizo que finalmente puede abrir la puerta a la evaluación de los genes que influyen en la inteligencia, la estatura o la belleza. Los niños podrían llegar a ser considerados algo así como mercancías, al menos por quienes puedan asumir el coste económico de la tecnología necesaria.
Sin embargo, también es perfectamente posible que las sociedades decidan la autorización del DGPI para algunas indicaciones, pero no para otras. Así, en Reino unido se ha prohibido su aplicación en la selección del sexo de los hijos por motivos sociales, y para la selección deliberada de hijos discapacitados, pero no para la prevención de las enfermedades.
También está lo que podríamos llamar la cuestión de la «materia prima». Los embriólogos que utilizan el DGPI sólo pueden trabajar con lo que ofrece la naturaleza, es decir, con los genes que poseen los progenitores. Podría estar muy bien diseñar una niña que tuviera el cerebro de Stephen Hawking y el cuerpo de Kate Moss; sin embargo, si papá y mamá no tienen esas características, será imposible que lo consigan.
El DGPI es una herramienta maravillosa para prevenir las enfermedades genéticas que afectan a grupos familiares generación tras generación; sin embargo, es un método completamente inadecuado para la producción en masa de «niños a la carta».
Cronología:
1978: Nacimiento de Louise Brown, la primera niña concebida mediante fecundación in vitro
1990: Desarrollo de la técnica del diagnóstico genético preimplantacional en el Hammersmith Hospital de Londres, y nacimiento de las gemelas Natalie y Danielle Edwards
2002: Nacimiento de Adam Nash, el primer niño concebido con el objetivo de convertirse en «hermano salvador»
La idea en síntesis: evaluación genética no es sinónimo de diseño