38 Terapia génica
Ashanti DeSilva es una estudiante universitaria norteamericana. Cuando nació, en 1986, no se contemplaba en absoluto la posibilidad de que pudiera alcanzar el nivel de la enseñanza secundaria, y mucho menos de que pudiera ir a la universidad. Ashanti sufría una enfermedad recesiva infrecuente denominada inmunodeficiencia combinada severa (SCID, sever combined immune deficiency), lo que quiere decir que su sistema inmunitario estaba alterado y que, por tanto, su exposición a cualquier microorganismo era extremadamente arriesgada.
Los niños con SCID viven de continuo al borde del desastre. Las infecciones leves para el resto de la población pueden causarles la muerte. Muchos de ellos fallecen durante la niñez, y los que sobreviven deben hacerlo protegidos y aislados del mundo exterior, razón por la cual esta enfermedad se ha denominado coloquialmente «síndrome del niño burbuja». Sin un trasplante de médula ósea procedente de un donante genéticamente compatible, son pocos los que alcanzan la edad adulta.
No fue posible encontrar un donante idóneo para Ashanti, pero en 1990 un grupo de investigadores del National Institute of Health halló una alternativa. El equipo dirigido por French Anderson extrajo alguno de los leucocitos ineficaces de la sangre de Ashanti y los infectó con un virus modificado que era portador de una copia normal del gen defectuoso de la niña. Al introducir de nuevo las células tratadas en su torrente sanguíneo, la función inmunitaria de Ashanti mejoró en un 40%. Fue la primera paciente tratada con éxito mediante terapia génica.
Nuestros amigos los virus La terapia génica no curó a Ashanti: las células genéticamente modificadas funcionaban durante unos meses, por lo que había que repetir el tratamiento. El método sólo se utilizó en los casos en los que el trasplante de médula ósea no era una opción. En el año 2000, un equipo del Great Ormond Street Hospital londinense y otro grupo de investigación del Necker Hospital parisiense refinaron el procedimiento para corregir la mutación en la médula ósea de los niños y que era la causa de la SCID, lo que podría dar lugar a una curación definitiva. Los buenos resultados iniciales permitieron albergar la esperanza de que la estrategia propuesta pudiera ser eficaz frente a esta y a otras enfermedades hereditarias.
El tratamiento actúa aprovechando las propiedades agresivas de uno de los enemigos microscópicos de la humanidad. Cuando los virus nos infectan, se reproducen mediante la introducción de su material genético en nuestras células, secuestrando, literalmente, los mecanismos de replicación de éstas y obligándolas a producir grandes cantidades de virus. Una de las clases de virus, la de los retrovirus, es capaz de incluirse en nuestro genoma mediante la activación de enzimas especializadas.
La medicina puede aprovechar esta capacidad de los virus para convertirlos en vectores que introduzcan ADN nuevo en las células. En primer lugar, se eliminan los genes de virulencia para que los virus sean inocuos y, después, se introducen en su código genético una copia normal del gen humano alterado. Cuando las células de un paciente son infectadas por este virus modificado, capturan el nuevo gen y comienzan a elaborar la proteína normal.
Terapia génica en las células germinales
Todas las formas de terapia génica que se han intentado hasta hoy se han aplicado a células somáticas, que constituyen la mayor parte de los tejidos y los órganos del cuerpo. Con ello se ha pretendido corregir defectos genéticos en pacientes concretos, pero —debido a que estas formas de terapia no actúan sobre las células germinales que producen los óvulos y los espermatozoides— las mutaciones se siguen transmitiendo a la descendencia.
Sin embargo, las técnicas del futuro pueden ir más allá con el diseño de las «terapias génicas que actúen sobre las células germinales» y que modifiquen los genes de los pacientes y de sus descendientes. Estas técnicas resultan más controvertidas, ya que las personas que todavía no han nacido no pueden opinar acerca de manipulaciones genéticas que podrían ocasionar consecuencias imprevistas. Sin embargo, los defensores de la aplicación de la terapia génica a las células germinales no comprenden tal alboroto, al menos cuando hablamos de enfermedades como la SCID o la fibrosis quística. Se preguntan qué habría de malo si fuera posible erradicar —para bien— un gen perjudicial dentro de un grupo familiar.
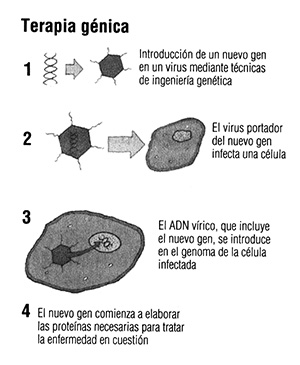
En lo que se refiere a algunos vectores víricos (como los adenovirus que causan con frecuencia cuadros de amigdalitis), el nuevo gen sólo permanece activo en las células infectadas en origen: cuando mueren, su progenie ya no expresa el rasgo añadido artificialmente. Ésta es la razón por la que Ashanti DeSilva necesita tratamientos repetidos. Sin embargo, si se utilizara un retrovirus, el nuevo gen quedaría incorporado en el genoma de las células que infectara y, así, se transmitiría a sus descendientes. El defecto genético quedaría corregido definitivamente.
Efectos adversos Los vectores víricos son clave en los métodos de terapia génica, pero también representan su principal punto débil, pues pueden afectar al cuerpo humano de manera impredecible. En el ensayo clínico Anglo-French SCID, en el que se utilizó un retrovirus para intentar corregir la SCID, el éxito tuvo un coste considerable. Hasta el momento, cinco de los 25 niños tratados han desarrollado leucemia.
Cuando un retrovirus se incorpora en el genoma de las células del huésped, los médicos no pueden controlar todos los efectos que pueden producirse. En ocasiones, el retrovirus anula el efecto de un oncogén y desencadena un proceso de división celular incontrolada con aparición de un cáncer. Sin embargo, dado que es posible la recuperación del 80% de los niños con leucemia (mientras que la SCID no tratada es invariablemente mortal), se puede argumentar que vale la pena asumir este riesgo.
La leucemia no es la única consecuencia negativa del uso de los vectores víricos. En 1999, un muchacho de 18 años de edad llamado Jesse Gelsinger y que padecía una enfermedad hepática genética participó en un ensayo clínico sobre terapia génica diseñada para el tratamiento de su enfermedad y que se llevó a cabo en la Universidad de Pennsylvania. El paciente sufrió una reacción inmunitaria masiva al vector utilizado, un adenovirus, que causó su fallecimiento.
En los ensayos clínicos sobre terapia génica que se realizan actualmente, los adenovirus y los retrovirus están siendo sustituidos por un vector distinto, un parvovirus no patógeno denominado «virus asociado a adenovirus» (necesita los adenovirus para su replicación). A diferencia de los retrovirus, los virus asociados a adenovirus se incorporan en el genoma siempre en una misma localización segura y, a diferencia de los adenovirus, no causan normalmente enfermedades en el ser humano, lo que hace que las reacciones inmunitarias excesivas sean improbables. En un ensayo clínico llevado a cabo con este nuevo vector vírico, ha sido posible mejorar la capacidad de visión de cuatro pacientes con amaurosis congénita de Leber, una enfermedad monogénica que causa ceguera. Otra opción prometedora la representan los vectores no víricos, como las proteínas sintéticas de dedos de cinc (zinc-finger proteins).
Dopaje genético
Resulta bastante complicado descubrir a los deportistas que utilizan sustancias, como la hormona del crecimiento humana, para incrementar su rendimiento físico. Sin embargo, la terapia génica podría hacerlo todavía más difícil. Los científicos ya han aplicado esta tecnología para modificar los genes de los ratones y los monos, de manera que produzcan mayores cantidades de las proteínas que incrementan su fuerza o su resistencia, como la eritropyetina (EPO). Esta forma de «dopaje genético» por parte de los deportistas sería imposible de demostrar en la práctica. Los individuos en quienes se demostrara la producción de cantidades excesivas de EPO alegarían, con razón, que la causa son sus genes. Serían necesarias pruebas genéticas sofisticadas (aún inexistentes) para demostrar que se ha inducido deliberadamente una potenciación genética artificial.
Aunque estas últimas técnicas quizá sean más seguras y ha remitido el interés de los científicos por la terapia génica, una cosa es la modificación de tejidos perfectamente localizados, como la médula ósea y las células de la retina, y otra muy distinta la corrección de defectos genéticos que causan efectos sistémicos, como la mutación de la fibrosis quística.
Además, la mayor parte de las enfermedades no se deben al efecto de un solo gen. La diabetes puede estar en relación con dos docenas de genes, y al modificación de todos ellos queda fuera del terreno de lo práctico. A pesar de que la terapia génica acabará ocupando un lugar en la medicina, no es una panacea para las enfermedades hereditarias.
Cronología:
1990: French Anderson (nacido en 1936) aplica por primera vez la terapia génica con éxito
1999: Fallecimiento de Jesse Gelsinger (1981-1999) durante un ensayo clínico con terapia génica
2000: Obtención de buenos resultados con una nueva técnica de terapia génica diseñada frente a la SCID por un equipo de investigación anglofrancés
2002: Interrupción del ensayo clínico Anglo-French SCID después de que varios pacientes desarrollaran leucemia; hasta el momento, uno de ellos ha fallecido
2008: Obtención de buenos resultados con la terapia génica como estrategia terapéutica en la amaurosis congénita de Leber, una enfermedad genética que causa ceguera
La idea en síntesis: a veces, las mutaciones pueden corregirse