24. LUZ BRILLANTE
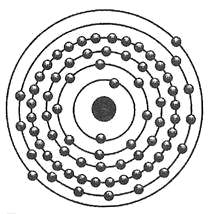
Tungsteno (W74)
¿Cuántos elementos necesitaría Dios para construir un universo? En 1815 se conocían cincuenta y pico; y si Dalton tenía razón, eso significaba cincuenta tipos distintos de átomos. Pero seguramente Dios no necesitaba cincuenta componentes básicos para su universo, seguramente lo habría concebido con más economía. William Prout, un físico de Londres con mentalidad de químico, al observar que las masas atómicas eran casi números enteros, conjeturó que el hidrógeno era de hecho el elemento primordial, y que todos los demás elementos habían sido construidos a partir de él. De este modo, Dios precisaba crear un solo tipo de átomo, y todos los demás, mediante «condensación» natural, se generarían a partir de éste.
Por desgracia, algunos elementos resultaron tener masas atómicas fraccionarias. Se podía redondear una masa que fuera ligeramente inferior o superior a un número entero (tal como hizo Dalton), pero ¿qué hacer con el cloro, por ejemplo, cuya masa atómica era de 35,5? Eso hizo que la hipótesis de Prout fuera difícil de mantener, y surgieron más dificultades cuando Mendeléiev hizo la tabla periódica. Estaba claro, por ejemplo, que el telurio, desde el punto de vista químico, venía antes que el yodo, pero su masa atómica, en lugar de ser menor, era mayor. Eran dificultades bastante graves, y sin embargo durante todo el siglo XIX la hipótesis de Prout siguió vigente, pues era tan hermosa, tan sencilla, que muchos químicos y físicos creían que debía de contener una verdad esencial.
¿Había quizá alguna propiedad atómica más integral, más fundamental que la masa atómica? Ésa era una pregunta que no se podría responder hasta que no se diera con un método de «sondear» el átomo, sondear, en concreto, su parte central, el núcleo. En 1913, un siglo después de Prout, un joven y brillante científico que trabajaba con Rutherford, Henry Moseley, comenzó a investigar átomos con la técnica recién desarrollada de la espectroscopia de rayos X. El montaje que hizo para su experimento era delicioso e infantil: utilizando un trenecito, en el que cada vagón llevaba un elemento distinto, lo desplazaba dentro de un tubo de vacío de un metro de largo, y bombardeaba cada elemento con rayos catódicos, haciendo que cada uno emitiera sus rayos X característicos. Cuando hizo una gráfica, poniendo las raíces cuadradas de las frecuencias en las ordenadas y el número atómico de los elementos en las abscisas, obtuvo una línea recta; y al hacer la gráfica de otra manera, vio que el incremento de la frecuencia mostraba saltos bruscos y discretos al pasar de un elemento a otro. Moseley pensó que eso tenía que reflejar una propiedad atómica fundamental, y que ésa sólo podía ser la carga nuclear.
El descubrimiento de Moseley le permitió (en palabras de Soddy) «pasar lista» de los elementos. En la secuencia no podía haber ningún hueco, sólo peldaños regulares y uniformes. Si había un hueco, significaba que faltaba un elemento. Se conocía con toda certeza el orden de los elementos, y que había noventa y dos elementos y sólo noventa y dos, del hidrógeno al uranio. Y ahora estaba claro que faltaban siete elementos, y sólo siete, aún por encontrar. Las «anomalías» que acompañaban a las masas atómicas se resolvieron: puede que el telurio tuviera un número atómico un poco mayor que el yodo, pero era el elemento 52, y el yodo el 53. Lo fundamental era el número atómico, no la masa atómica.
La brillantez y rapidez del trabajo de Moseley, realizado en unos pocos meses de 1913—1914, produjo reacciones encontradas entre los químicos. Algunos científicos de más edad se preguntaban quién era ese mocoso que creía haber completado la tabla periódica, eliminando así la posibilidad de descubrir ningún otro elemento, aparte de los que él había designado. ¿Y qué sabía de química, o de los largos y arduos procesos de destilación, filtrado, cristalización que podían ser necesarios para concentrar un nuevo elemento o analizar un nuevo compuesto? Pero Urbain, uno de los más grandes químicos analíticos —un hombre que había llevado a cabo quince mil cristalizaciones fraccionadas para aislar el lutecio—, enseguida apreció la magnitud de la labor de Moseley, y vio que, lejos de suponer un obstáculo a la autonomía de la química, Moseley, de hecho, había confirmado la tabla periódica y reafirmado su posición central. «La ley de Moseley… confirmó en pocos días las conclusiones de mis veinte años de paciente labor.»
Los números atómicos se habían utilizado anteriormente para indicar la secuencia ordinal de los elementos clasificados por su masa atómica, pero Moseléy les dio auténtico significado. El número atómico indicaba la carga nuclear, indicaba la identidad del elemento, su identidad química, de una manera absoluta y segura. Existían, por ejemplo, varias formas del plomo —isótopos— con masas atómicas distintas, pero todos tenían el mismo número atómico, el 82. El plomo era, esencialmente y por antonomasia, el número 82, y no podía cambiar su número atómico sin dejar de ser plomo. El tungsteno era, de manera necesaria e inevitable, el elemento 74. Pero ¿cómo le otorgaba su identidad el número 74?
Aunque Moseley había mostrado cuál era el auténtico número y orden de los elementos, aún quedaban sin responder algunas cuestiones fundamentales, cuestiones que habían desconcertado a Mendeléiev y a los científicos de su tiempo, cuestiones que habían desconcertado al tío Abe en su juventud, y cuestiones que ahora me desconcertaban a mí, a medida que los placeres de la química, la espectroscopia y el jugar con la radiactividad daban paso a un furioso ¿por qué?, ¿por qué?, ¿por qué? ¿Por qué existían elementos, en primer lugar, y por qué tenían las propiedades que tenían? ¿Qué hacía que los metales alcalinos y los halógenos, de maneras opuestas, fueran tan violentamente activos? ¿Qué explicaba la similitud de las tierras raras y los hermosos colores y propiedades magnéticas de sus sales? ¿Qué generaba el singular y complejo espectro de los elementos y las regularidades numéricas que Balmer había descubierto en ellos? ¿Y qué, por encima de todo, permitía que los elementos fueran estables, se mantuvieran inmutables durante billones de años, no sólo sobre la tierra, sino, al parecer, también en el sol y las estrellas? Ésas eran las cuestiones a las que el tío Abe había dado vueltas de joven, cuarenta años antes; pero en 1913, me contó, todas esas preguntas y muchas más habían obtenido, en principio, respuesta, abriendo de pronto todo un nuevo mundo de conocimiento.
Rutherford y Moseley se habían interesado principalmente por el núcleo del átomo, su masa y sus unidades de carga eléctrica. Pero eran los electrones en sus órbitas, probablemente, su organización, su vínculo, los que determinaban las propiedades químicas del elemento, y también (parecía probable) muchas de sus propiedades químicas. Y era con los electrones con lo que fallaba el modelo de átomo de Rutherford. Según la física clásica maxwelliana, un átomo basado en el modelo de sistema solar no podía funcionar, pues los electrones, al girar alrededor del núcleo más de un trillón de veces por segundo, crearían radiación en forma de luz visible, y ese átomo emitiría un momentáneo destello de luz, y luego se desplomaría hacia el interior, pues sus electrones, al perder su energía, se desmoronarían dentro del núcleo. Pero el hecho (exceptuando la radiactividad) era que los elementos y sus átomos duraban billones de años, en realidad para siempre. ¿Cómo podía entonces un átomo ser estable, resistir lo que parecía un destino casi instantáneo?
Había que invocar o inventar principios completamente nuevos para aceptar esa imposibilidad. Y el aprenderlos constituyó el tercer éxtasis de mi vida, al menos de mi vida «química»: el primero había ocurrido al descubrir a Dalton y su teoría atómica, y el segundo con Mendeléiev y su tabla periódica. Pero creo que el tercero era el más asombroso de todos, porque contravenía (o eso parecía) toda la ciencia clásica que yo conocía, y todo lo que sabía de la racionalidad y la causalidad.
Fue Niels Bohr, que también trabajaba en el laboratorio de Rutherford en 1913, quien dio el salto imposible, unificando el modelo atómico de Rutherford y la teoría cuántica de Planck. La idea de que la energía no se absorbía o emitía de manera continua, sino en paquetes discretos, en «cuantos», había pasado desapercibida, como una bomba de relojería, desde que Planck la sugiriera en 1900. Einstein había utilizado la idea en relación con los efectos fotoeléctricos, pero, por lo demás, la teoría cuántica y su potencial revolucionario había sido curiosamente olvidada, hasta que Bohr se sirvió de ella para sortear las imposibilidades del átomo de Rutherford. La idea clásica, el modelo de sistema solar, permitiría a los electrones una infinidad de órbitas, todas inestables, todas desmoronándose hacia el núcleo. Bohr postuló, por contra, un átomo que poseía un número limitado de órbitas discretas, cada una de ellas con un nivel de energía específico o estado cuántico. El menos energético de estos estados, el más cercano al núcleo, lo llamó Bohr «estado básico»: un electrón podía permanecer ahí para siempre, describiendo órbitas alrededor del núcleo, sin emitir ni perder energía. Era un postulado de asombrosa y extraordinaria audacia, que implicaba que la teoría clásica del electromagnetismo podría ser inaplicable en el ínfimo ámbito del átomo.
En aquel momento era algo que no podía probarse: era un puro salto de inspiración, de imaginación, no muy distinto de los saltos que ahora postulaba para los propios electrones, pues estos saltaban, sin advertencia ni estados intermedios, de un nivel energético a otro. Porque, además del estado de reposo del electrón, postuló Bohr, había otras órbitas de energía superior, «estados estacionarios» de energía más elevada, a los que los electrones podían desplazarse brevemente. De este modo, si un átomo absorbía energía de la frecuencia adecuada, un electrón se podía desplazar de su estado de reposo a otra órbita de energía superior, aunque tarde o temprano regresaría a su estado de reposo original, emitiendo energía exactamente de la misma frecuencia que la que había absorbido, que era lo que ocurría en el caso de la fluorescencia o la fosforescencia, lo que explicaba la identidad de la emisión espectral y de las líneas de absorción, que había constituido un misterio durante más de cincuenta años.
Los átomos, según Bohr, no podían absorber ni emitir energía excepto mediante esos saltos cuánticos, y las líneas discretas de sus espectros eran simplemente la expresión de las transiciones entre sus estados estacionarios. Los incrementos entre los niveles de energía eran menores cuanto más lejos del núcleo, y Bohr calculó que esos intervalos correspondían exactamente a las líneas del espectro del hidrógeno (y a la fórmula de Balmer para esas líneas). Esta coincidencia entre teoría y realidad fue el primer gran triunfo de Bohr. Einstein consideró que el trabajo de Bohr era «un logro inmenso», y, al rememorarlo treinta y cinco años después, escribió: «Incluso hoy me parece un milagro… Es la forma más elevada de musicalidad en la esfera del pensamiento.» Bohr comentó que el espectro del hidrógeno —los espectros en general— habían sido tan hermosos y carentes de significado como las marcas de las alas de las mariposas, pero ahora podía verse que reflejaban los estados de energía dentro del átomo, las órbitas cuánticas en las que los electrones giraban y cantaban. «El lenguaje de los espectros», escribió el gran espectroscopista Arnold Sommerfeld, «se ha revelado como la música atómica de las esferas.»
¿Podía ampliarse la teoría cuántica a átomos más complejos y multielectrónicos? ¿Podía explicar las propiedades químicas, explicar la tabla periódica? En ello se centraría Bohr al reemprender su vida científica después de la Segunda Guerra Mundial.[89]
A medida que uno pasaba a números atómicos mayores, a medida que la carga nuclear o número de protones del núcleo aumentaba, había que añadir un número igual de electrones para que la carga del átomo siguiera siendo neutra. Pero Bohr concibió que la suma de estos electrones a un átomo se hacía de manera jerárquica y ordenada. Si al principio se había interesado sobre todo por las órbitas potenciales del solitario electrón de hidrógeno, ahora ampliaba su idea a una jerarquía de órbitas o capas para todos los elementos. Propuso que estas capas tenían niveles de energía propios definidos y discretos, de modo que si se añadían electrones uno por uno, éstos ocuparían primero la órbita disponible de menor energía, y cuando ésta estuviera llena, la órbita siguiente de menor energía, y así sucesivamente. Las órbitas de Bohr se correspondían con los períodos de Mendeléiev, de manera que las órbitas primeras y más interiores, al igual que el primer período de Mendeléiev, acomodaban a dos elementos, y sólo a dos. Una vez esa órbita estaba completa con sus dos electrones, comenzaba una segunda, y ésta, al igual que el segundo período de Mendeléiev, podía acomodar a ocho electrones y no más. Lo mismo pasaba con el tercer período u órbita. Bohr consideró que mediante esa construcción de abajo arriba, o Aufbau, todos los elementos podían construirse de manera sistemática, y, de manera natural, ocuparían los lugares que les correspondían en la tabla periódica.
De este modo, la posición de cada elemento en la tabla periódica representaba el número de electrones de sus átomos, y la reactividad y unión de cada elemento podían verse en términos electrónicos, según los electrones que había en la órbita exterior, los así llamados electrones valencia. Los gases inertes tenían sus órbitas exteriores completas con ocho electrones, lo que hacía que prácticamente no reaccionaran con ningún otro elemento. Los metales alcalinos, en el Grupo I, sólo tenían un electrón en su órbita exterior, por lo que poseían una gran avidez a la hora de liberarse de él y conseguir la configuración de un gas inerte; los halógenos del Grupo VII, por el contrario, con siete electrones en su órbita de valencia, estaban ávidos de obtener un electrón extra y conseguir la configuración de un gas inerte. Así, cuando el sodio entraba en contacto con el cloro, había una unión inmediata (de hecho explosiva), y cada átomo de sodio entregaba su electrón extra, y cada átomo de cloro lo recibía con gran alegría, ionizándose ambos en el proceso.
La ubicación de los elementos de transición y las tierras raras en la tabla periódica siempre había dado lugar a importantes problemas. Bohr sugería ahora una solución elegante e ingeniosa: los elementos de transición, propuso, contenían una capa adicional de tres electrones cada uno; las tierras raras una capa adicional de catorce. Estas órbitas interiores, profundamente enterradas en el caso de las tierras raras, no afectaban al carácter químico del elemento de una manera tan extrema como las órbitas exteriores; de aquí el parecido relativo entre todos los elementos de transición, y la extrema similitud de todas las tierras raras.
La tabla periódica electrónica de Bohr, basada en la estructura atómica, era esencialmente la misma que la empírica de Mendeléiev, basada en la reactividad química (y todas ellas idénticas a las tablas de bloques concebidas en épocas preelectrónicas, como la tabla piramidal de Thomsen y la tabla ultralarga de Werner de 1905). Se infiriera la tabla periódica de las propiedades químicas de los elementos o de las órbitas electrónicas de sus átomos, se llegaba exactamente al mismo punto.[90] Moseley y Bohr habían dejado absolutamente claro que la tabla periódica se basaba en una serie numérica fundamental que determinaba el número de elementos de cada período: dos en el primero, ocho en el segundo y el tercero, dieciocho en el cuarto y el quinto; treinta y dos en el sexto y quizá también en el séptimo. Yo repetía las series —2, 8, 8, 18, 18, 32— una y otra vez en mi cabeza.
A partir de entonces comencé a visitar de nuevo el Museo de la Ciencia y a pasar horas contemplando la gigantesca tabla periódica que había allí, concentrándome esta vez en los números atómicos anotados en rojo en cada cubículo. Contemplaba el vanadio, por ejemplo —había una reluciente pepita en su casillero— y pensaba en él como el elemento 23, un 23 que era 5 + 18: cinco electrones en la órbita exterior alrededor de un «centro» de argón de dieciocho. Cinco electrones, de ahí su valencia máxima de 5; pero tres de ellos formaban una capa interior incompleta, y ahora sabía que era esa capa incompleta la que daba origen a los colores y predisposición magnética característicos del vanadio. Esta noción cuantitativa no sustituía a la noción concreta y fenoménica del vanadio, sino que la intensificaba, pues ahora la veía como una revelación, en términos químicos, de por qué el vanadio poseía esas propiedades y no otras. Lo cualitativo y lo cuantitativo se fusionaban en mi mente; uno podía acercarse al concepto «vanadio» desde cualquiera de los dos extremos.
Entre ellos, Bohr y Moseley me habían hecho volver a la aritmética, me habían mostrado la aritmética esencial y transparente de la tabla periódica que quedaba insinuada, aunque de una manera confusa, por las masas atómicas. El carácter e identidad de los elementos, en gran parte, al menos, podía inferirse de sus números atómicos, que ya no sólo indicaban la carga nuclear, sino que representaban la arquitectura misma del átomo. Todo era divinamente hermoso, lógico, simple, económico, el ábaco de Dios en funcionamiento.
¿Qué hacía que los metales fueran metálicos? La estructura electrónica explicaba por qué el estado metálico parecía ser fundamental, tan distinto en carácter de cualquier otro. Algunas de las propiedades mecánicas de los metales, sus elevadas densidades y puntos de fusión, ahora podían explicarse por lo fuertemente unidos que los electrones estaban al núcleo. Un átomo fuertemente unido, con una elevada «energía de unión», parecía acompañar a las características de dureza, densidad y elevado punto de fusión. Así, mis metales favoritos —el tantalio, el tungsteno, el renio, el osmio: los metales filamentosos— poseían las energías de unión más elevadas de todos los elementos. (De modo que, con gran satisfacción, vi que existía una justificación atómica de sus excepcionales cualidades… y de que fueran mis preferidos.) La conductividad de los metales se atribuía a un «gas» de electrones libres y móviles, fácilmente separable de sus átomos padres: ello explicaba por qué un campo eléctrico atraía una corriente de electrones móviles a través de un cable. Ese océano de electrones libres sobre la superficie del metal también explicaba su brillo especial, pues al oscilar violentamente con el impacto de la luz, desperdigaban o reflejaban cualquier luz que surgiera en su camino.
La teoría del gas electrónico también implicaba que bajo condiciones extremas de temperatura y presión, todos los elementos no metálicos, toda la materia, podían pasar a estado metálico. Eso ya se había conseguido con el fósforo en los años veinte, y en los años treinta se predijo que, a presiones superiores a un millón de atmósferas también se podría lograr con el hidrógeno, y se especuló que podría existir hidrógeno metálico en el corazón de gigantes de gas como Júpiter. La idea de que todo pudiera «metalizarse» me parecía profundamente satisfactoria.[91]
Durante mucho tiempo me habían desconcertado los peculiares poderes de la luz azul o violeta, una luz de onda corta, en oposición a la luz roja o de onda larga. Eso quedaba claro en el cuarto oscuro: se podía encender una brillante luz roja y no se velaba la película, mientras que al menor atisbo de luz blanca, luz del día (que por supuesto contenía luz azul), se velaba de inmediato. También era evidente en el laboratorio, donde el cloro, por ejemplo, podía mezclarse sin peligro alguno con hidrógeno en presencia de luz roja, pero la mezcla explotaba si había la menor luz blanca. Y también era evidente en la vitrina de minerales del tío Dave, donde se podía provocar la fluorescencia o la fosforescencia con luz azul o violeta, pero no con luz naranja o roja. Y estaban, por fin, las células fotoeléctricas que el tío Abe guardaba en su casa; éstas quedaban activadas con el más leve haz de luz azul, pero no reaccionaban ni ante un foco de luz roja. ¿Cómo era posible que una gran cantidad de luz roja fuera menos efectiva que una ínfima cantidad de luz azul? Sólo después de conocer las conclusiones de Bohr y Planck comprendí que la respuesta a esas aparentes paradojas tenía que residir en la naturaleza cuántica de la radiación y la luz, y en los estados cuánticos del átomo. La luz o la radiación se emitía en unidades mínimas o cuantos, cuya energía dependía de su frecuencia. Un cuanto de luz de onda corta —un cuanto azul, por así decir— poseía más energía que uno rojo, y un cuanto de rayos X o rayos gamma tenía aún mucha más energía. Cada tipo de átomo o molécula —ya fuera de una sal de plata en una emulsión fotográfica, o de hidrógeno o cloro en el laboratorio, o de cesio o selenio en las células fotoeléctricas del tío Abe, o de sulfuro o tungstato de calcio en la vitrina del minerales del tío Dave— precisaba cierto nivel específico de energía para provocar una reacción; y eso podía lograrse mediante un solo cuanto de alta energía, mientras que nada conseguían miles de cuantos de baja energía.
De niño pensaba que la luz tenía forma y tamaño, las formas como de flor de las llamas de las velas, como magnolias sin abrir, los polígonos luminosos de las bombillas de tungsteno de mi tío. Fue sólo cuando el tío Abe me mostró su espintariscopio y vi las chispas individuales del aparato cuando comencé a comprender que la luz, toda la luz, procedía de átomos o moléculas que habían sido primero excitados, y que luego, al regresar a su estado de reposo, liberaban su exceso de energía como radiación visible. Al calentar un sólido, como por ejemplo un filamento hasta dejado al rojo blanco, se emitían energías de muchas longitudes de onda; con un vapor incandescente, como el sodio en una llama de sodio, sólo se emitían ciertas longitudes de onda específicas. (Posteriormente descubrí que la luz azul de la llama de una vela, que tanto me había fascinado de niño, la generaban moléculas dicarbónicas que al enfriarse emitían la energía que habían absorbido al calentarse.)
Pero el sol y las estrellas no eran como las luces de la tierra. Poseían un brillo y una blancura que superaba las lámparas de filamentos más calientes (algunas, como Sirio, eran casi azules). De la energía de radiación del sol se podía inferir que la temperatura de la superficie tenía que ser de unos 6.000 grados. El tío Abe me recordó que nadie, en su juventud, tenía ni la más remota idea de qué podía provocar la enorme incandescencia y energía del sol. Pero incandescencia no parecía la palabra más adecuada, pues no ardía, no había combustión, en el sentido corriente, y, además, casi todas las reacciones químicas cesaban por encima de los 1.000 grados.
¿Podía la energía gravitacional, la energía generada por una masa gigantesca al contraerse, mantener el sol en funcionamiento? Parecía que eso tampoco podía explicar el calor y la energía abrasadores del sol y las estrellas, sin mengua durante billones de años. Y tampoco la radiactividad parecía una fuente plausible de energía, pues en las estrellas no había elementos radiactivos en una cantidad ni remotamente suficiente, y su emisión de energía era demasiado lenta y no había manera de acelerarla.
Hasta 1929 no surgió una idea nueva: la de que los átomos de los elementos ligeros, dadas las prodigiosas temperaturas y presiones que había en el interior de una estrella, podían fusionarse para formar átomos más pesados, que los átomos de hidrógeno, para empezar, se fusionaran para formar helio; que la fuente de energía cósmica, en una palabra, era termonuclear. Había que bombear grandes cantidades de energía hacia el interior de los núcleos ligeros para hacer que se fusionaran, pero una vez se había alcanzado la fusión, la energía que se emitía era incluso mayor; lo cual, a su vez, calentaba y fusionaba otros núcleos ligeros, produciendo aún más energía, y eso era lo que mantenía en marcha la reacción termonuclear. El interior del sol alcanza enormes temperaturas, del orden de los veinte millones de grados. Me parecía difícil imaginar una temperatura como ésa, pues una estufa a esa temperatura (escribió George Gamow en Nacimiento y muerte del sol) destruiría todo cuanto tuviera a su alrededor en cientos de kilómetros.
A temperaturas y presiones como ésas, los núcleos atómicos —desnudos, despojados de sus electrones— daban vueltas a una velocidad tremenda (la energía media de su movimiento térmico sería similar a la de las partículas alfa) y continuamente colisionaban, sin que nada los amortiguara, unos contra otros, fusionándose para formar los núcleos de los elementos más pesados.
Debemos imaginar el interior del sol [escribió Gamow] como una especie de gigantesco laboratorio alquímico natural, donde la transformación de diversos elementos en otros tiene lugar con la misma facilidad con que ocurren las reacciones químicas corrientes en nuestros laboratorios de la tierra.
La conversión del hidrógeno en helio producía inmensas cantidades de luz y calor, pues la masa del átomo de helio era ligeramente menor que la de cuatro átomos de hidrógeno, y esa pequeña diferencia de masa se transformaba completamente en energía, según la famosa fórmula de Einstein e = mc2. Para producir la energía que se generaba en el sol, cientos de millones de toneladas de hidrógeno tenían que convertirse en helio cada segundo, pero el sol está compuesto predominantemente de hidrógeno, y tan enorme es su masa que sólo una pequeña fracción se ha consumido desde que la tierra existe. Si la velocidad de fusión declinara, el sol se contraería y se calentaría, recuperando la velocidad de fusión; si la velocidad de fusión se hiciera demasiado grande, el sol se expandiría y se enfriaría, frenándola. De este modo, tal como lo expresaba Gamow, el sol representaba «la “máquina nuclear” más ingeniosa, y quizá la única posible», un horno que se autorregulaba, y en el que la fuerza explosiva de la fusión nuclear quedaba perfectamente equilibrada por la fuerza de la gravitación. La fusión del hidrógeno para formar helio no sólo proporcionaba una inmensa cantidad de energía, sino que creaba un nuevo elemento en el mundo. Y los átomos de helio, dado el suficiente calor, podían fusionarse para crear elementos más pesados, y estos elementos, a su vez, creaban elementos aún más pesados.
Así, mediante una emocionante convergencia, se solucionaban al mismo tiempo dos antiguos problemas: el brillo de las estrellas y la creación de los elementos. Bohr había imaginado una Aufbau, una construcción de todos los elementos comenzando por el hidrógeno, como un modelo puramente teórico, pero resultaba que tal Aufbau tenía lugar en las estrellas. El hidrógeno, el elemento 1, no era sólo el combustible del universo, era su componente básico, el átomo primordial, tal como Prout había pensado ya en 1815. La idea de que todo lo que uno precisaba para empezar era el primer y más sencillo de los átomos parecía muy elegante, muy satisfactoria.[92]
El átomo de Bohr me parecía de una belleza inefable, trascendente: los electrones girando trillones de veces por segundo, eternamente, en órbitas predestinadas, una auténtica máquina de movimiento perpetuo gracias a la irreductibilidad del cuanto y al hecho de que el electrón al girar no gastaba energía, no hacía ningún trabajo. Y los átomos más complejos eran aún más hermosos, pues poseían docenas de electrones tejiendo caminos separados, pero organizados, como diminutas cebollas, en órbitas y subórbitas. Esas cosas tan sutiles e indestructibles me parecían no sólo hermosas, sino perfectas a su manera, tan perfectas como ecuaciones (que de hecho podían expresarlas) en su equilibrio de números y fuerzas, protecciones y energías. Y nada, ninguna acción corriente, podía alterar sus perfecciones. Los átomos de Bohr estaban sin duda muy cerca del mundo óptimo de Leibniz.
«Dios piensa en números», solía decir la tía Len. «Los números son la manera en que se ensambla el mundo.» Esta idea nunca me había abandonado, y ahora me parecía abarcar todo el mundo físico. En aquella época había comenzado a leer algo de filosofía, y Leibniz, en la medida que podía comprenderlo, me atraía especialmente. Hablaba de una «matemática divina», con la que uno podía crear la realidad más rica posible mediante los medios más económicos, y eso, ahora me parecía, podía verse en todas partes: en la hermosa economía mediante la cual millones de compuestos se creaban a partir de unas decenas de elementos, y los ciento y pico elementos que procedían del hidrógeno; la economía mediante la cual toda la variedad de átomos se componía de dos o tres partículas, y en la manera que su estabilidad e identidad quedaban garantizadas por los números cuánticos de los propios átomos: todo eso era lo bastante bello como para ser obra de Dios.