23. EL MUNDO LIBERADO
Los Curie observaron desde el principio que sus sustancias radiactivas exhibían un extraño poder de «inducir» la radiactividad a cuanto las rodeaba. El hecho les pareció sumamente enigmático, pues la contaminación de su equipo hacía casi imposible medir la radiactividad de las propias muestras:
Los diferentes objetos utilizados en el laboratorio químico [escribió Marie en su tesis]… pronto adquirieron radiactividad. Las partículas de polvo, el aire de la habitación, las ropas, todo se volvió radiactivo. El aire de la habitación se convierte en conductor. En nuestro laboratorio el mal se ha vuelto agudo, y ya no tenemos ningún aparato debidamente aislado.[86]
Mientras leía ese párrafo me acordé de la casa del tío Abe y de la nuestra, preguntándome si también ellas, aunque de una manera mucho menos intensa, estaban radiactivas, si las esferas pintadas de radio de los relojes del tío Abe inducían radiactividad en todo lo que les rodeaba, y llenaban el aire, en silencio, de rayos penetrantes.
Los Curie (al igual que Becquerel) primero atribuyeron esa «radiactividad inducida» a algo inmaterial, la consideraron una «resonancia», quizá análoga a la fosforescencia o a la fluorescencia. Pero también había indicios de que se trataba de una emisión material. Ya en 1897 descubrieron que si el torio se guardaba en un frasco herméticamente cerrado su radiactividad se incrementaba, y que regresaba a su nivel anterior en cuando el frasco se abría. Pero no profundizaron en esta observación, y fue Ernest Rutherford el primero en darse cuenta de lo que eso implicaba: que una nueva sustancia se estaba produciendo, era generada por el torio; una sustancia mucho más radiactiva que su progenitora.
Rutherford consiguió la ayuda del joven químico Frederick Soddy, y entre los dos fueron capaces de demostrar que la «emanación» del torio era, de hecho, una sustancia material, un gas, que podía aislarse. Se podía licuar tan fácilmente como el cloro, pero no reaccionaba con ningún reactivo químico; de hecho era tan inerte como el argón y los demás gases inertes recién descubiertos. En ese punto Soddy pensó que la «emanación» del torio podría ser argón, y (como escribió posteriormente) quedó
invadido por algo más poderoso que la alegría —no puedo expresarlo muy bien—, por una especie de euforia… Recuerdo perfectamente haberme quedado de pie, paralizado, casi aturdido por el colosal impacto que aquello me había causado y soltar bruscamente, o eso me pareció en ese momento: «Rutherford, ésta es la transmutación: el torio se desintegra y se transmuta en gas argón.»
Como de costumbre, Rutherford demostró en su respuesta ser consciente de las repercusiones más prácticas: «Por favor, Soddy, no lo llame transmutación. Nos cortarán la cabeza como si fuésemos alquimistas.»
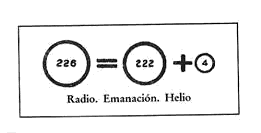
Pero el nuevo gas no era argón; era un elemento nuevo que poseía un espectro de línea brillante único. Se difundía muy lentamente y era enormemente denso: 111 veces más denso que el hidrógeno, mientras que el argón sólo era 20 veces más denso. Suponiendo que una molécula del nuevo gas fuera monoatómica, que contuviera un solo átomo, al igual que los demás gases inertes, su masa atómica sería de 222. De este modo, era el último y más pesado de la serie de gases inertes, y como tal podía ocupar su lugar en la tabla periódica, como último miembro del Grupo 0 de Mendeléiev. Rutherford y Soddy lo llamaron provisionalmente torón o Emanación.
El torón desaparecía a gran velocidad: la mitad se había evaporado en un minuto, las tres cuartas partes en dos minutos, y en diez minutos ya no era detectable. Fue la rapidez de esta descomposición (y la aparición en su lugar de un depósito radiactivo) lo que les permitió a Rutherford y a Soddy darse cuenta de algo que no había quedado claro con el uranio o el radio: que había una desintegración continua de los átomos de los elementos radiactivos, y que con ello se transformaban en otros átomos.
Se dieron cuenta de que cada elemento radiactivo poseía una velocidad característica de descomposición, su período de semidesintegración o «vida media». La vida media de un elemento podía darse con extraordinaria precisión, de modo que la de un isótopo de radón, por ejemplo, podía calcularse en 3,8235 días. Pero la vida de un átomo individual no podía predecirse de ninguna manera. Esta idea me dejaba más y más perplejo, y una y otra vez leía la explicación de Soddy:
Las posibilidades en cualquier instante de que un átomo se desintegre o no en un segundo concreto son fijas. No tienen nada que ver con ninguna consideración externa o interna que conozcamos, y, en concreto, no aumentan por el hecho de que el átomo ya lleve viviendo un tiempo… Lo único que puede decirse es que la causa inmediata de la desintegración atómica parece deberse al azar.
La vida de un átomo individual, al parecer, podía variar de cero a infinito, y no había nada que distinguiera a un átomo «dispuesto» a desintegrarse de uno al que todavía le quedara mil millones de años por delante.
Todo esto me parecía profundamente desconcertante: que un átomo pudiera desintegrarse en cualquier momento sin «razón» alguna. Parecía sacar la radiactividad del ámbito de la continuidad o el proceso, del universo causal e inteligible, y apuntaba a una esfera en la que las leyes clásicas no significaban nada en absoluto.
La vida media del radio era mucho más larga que la de su emanación, el radón: unos 1.600 años. Pero ésta era todavía muy pequeña comparada con la edad de la tierra: ¿por qué, entonces, si se descomponía constantemente, no había desaparecido todo el radio de la tierra hacía mucho tiempo? La respuesta, infirió Rutherford, y no tardó en poder demostrarlo, era que el propio radio lo producían elementos con una vida media mucho más larga, toda una serie de sustancias cuyo origen se remontaba hasta el elemento padre, el uranio. El uranio, a su vez, tenía una vida media de cuatro mil millones y medio de años, más o menos la edad de la tierra. Otra cascada de elementos se derivaba del torio, que tenía una vida media aún más larga que la del uranio. De este modo, la tierra seguía viviendo, en términos de energía atómica, del uranio y el torio que habían estado presentes cuando se formó.
Estos descubrimientos tuvieron un impacto fundamental sobre el prolongado debate acerca de la edad de la tierra. El gran físico Kelvin, a principios de la década de 1860, poco después de la publicación de El origen de las especies, había argumentado que, basándose en la velocidad de enfriamiento, y suponiendo que la única fuente de calor fuera el sol, la tierra no podía tener más de veinte millones de años, y que en otros cinco millones de años estaría tan fría que no habría vida. Ese cálculo no sólo era desalentador, sino imposible de conciliar con los fósiles, que indicaban que la vida tenía cientos de millones de años de antigüedad, y, sin embargo, no había manera de refutarlo. El hecho tenía enormemente preocupado a Darwin.
Fue sólo con el descubrimiento de la radiactividad como se solucionó el enigma. El joven Rutherford se opuso enérgicamente al famoso Lord Kelvin, que por entonces tenía ochenta años, y sugirió que los cálculos de Kelvin se basaban en una suposición falsa. Había otra fuente de calor además del sol, dijo Rutherford, y que además era muy importante para la tierra. Los elementos radiactivos (principalmente el uranio y el torio, y los productos de su descomposición, pero también un isótopo radiactivo del potasio) habían servido para mantener la tierra caliente durante millones de años y para protegerla del enfriamiento prematuro que Kelvin había predicho. Rutherford tomó un trozo de pechblenda, cuya edad había calculado a partir de la cantidad de helio que contenía. Ese trozo de tierra, dijo, tenía al menos quinientos millones de años de antigüedad.
Rutherford y Soddy pudieron por fin dedicarse a seguir el rastro de tres cascadas radiactivas distintas, cada una de las cuales contenía más o menos una docena de productos que procedían de la desintegración de los elementos padres originales. ¿Podían ser estos productos de descomposición elementos diferentes? En la tabla periódica no había sitio entre el bismuto y el torio para tres docenas de elementos; quizá lo hubiera para media docena, pero no mucho más. Sólo gradualmente quedó claro que muchos elementos no eran más que una versión de otro; las emanaciones del radio, el torio y el actinio, por ejemplo, aunque poseían vidas medias enormemente distintas, eran químicamente idénticas, el mismo elemento todas ellas, aunque con masas atómicas ligeramente distintas. (Posteriormente Soddy los llamaría isótopos.) y los productos finales de cada serie eran similares: el radio G, el actinio E y el torio E eran todos ellos isótopos del plomo.
Todas las sustancias de esas cascadas de radiactividad poseían una firma de radio única, una vida media de duración fija e invariable, así como una emisión de radiación característica, y eso fue lo que permitió que Rutherford y Soddy los clasificaran, y al hacerlo descubrieron una ciencia nueva: la radioquímica.
La idea de la desintegración atómica, primero apuntada y luego desechada por Marie Curie, ya no podía seguir negándose. Era evidente que toda sustancia radiactiva se desintegraba en el momento de emitir energía y se convertía en otro elemento, y que esa transmutación era inseparable de la radiactividad.
Me encantaba la química en parte porque era una ciencia de transformaciones, de innumerables compuestos a partir de media docena de elementos, todos ellos fijos, invariables y eternos. La idea de que esos elementos fueran invariables y estables era, psicológicamente, crucial para mí, pues me parecían puntos fijos, anclas, en un mundo inestable. Pero ahora la radiactividad traía transformaciones de lo más increíble. ¿A qué químico se le hubiera ocurrido pensar que del uranio, un metal duro, parecido al tungsteno, podía surgir un metal alcalinotérreo como el radio, un gas inerte como el radón, un elemento parecido al telurio como el polonio, formas radiactivas de bismuto y talio, y finalmente, plomo: ejemplos de casi todos los grupos de la tabla periódica?
Era algo que ningún químico podía haber concebido (aunque quizá sí un alquimista), pues esas transformaciones quedaban fuera del ámbito de la química. Ningún proceso químico, ningún ataque químico, podía llegar a alterar la identidad de un elemento, y eso también se aplicaba a los elementos radiactivos. El radio, químicamente, se comportaba de manera similar al bario; su radiactividad era una propiedad por completo distinta, que nada tenía que ver con sus propiedades químicas o físicas. La radiactividad era una propiedad maravillosa (o terrible) que se añadía a las demás, totalmente distinta (y una propiedad que a veces me irritaba, pues me encantaba la densidad parecida al tungsteno del uranio metálico, y la fluorescencia y belleza de sus minerales y sales, pero tenía la impresión de que su manipulación enseguida resultaba peligrosa; de manera parecida, me enfurecía la intensa radiactividad del radón, que por lo demás habría sido un gas pesado ideal).
La radiactividad no alteraba las realidades de la química, ni la noción de los elementos; no ponía en entredicho la idea de su estabilidad o identidad. Pero sí apuntaba a que el átomo poseía dos ámbitos: uno relativamente superficial y accesible que gobernaba la reactividad química y la combinación, y otro más profundo, inaccesible a todos los agentes químicos y físicos corrientes y a sus energías relativamente pequeñas, donde cualquier cambio producía una alteración fundamental de la identidad del elemento.
El tío Abe tenía en su casa un «espintariscopio», exactamente igual que el que aparecía anunciado en la portada de la tesis de Marie Curie. Era un instrumento de hermosa simplicidad, que consistía en una pantalla fluorescente y un ocular de aumento, y, en el interior, un fragmento infinitesimal de radio. Al mirar a través del ocular se veían docenas de destellos por segundo. Cuando el tío Abe me lo entregó y me lo acerqué al ojo, el espectáculo me pareció delicioso, mágico, como observar una interminable sucesión de meteoros y estrellas fugaces.
Los espintariscopios, que costaban unos pocos chelines, eran juguetes científicos de moda en los salones eduardianos, un nuevo avance exclusivo del siglo XX, en comparación con los estereoscopios y los tubos de Geissler, heredados de la época victoriana. Pero si aparecieron como una especie de juguete, rápidamente se apreció que mostraban algo enormemente importante, pues las diminutas chispas o destellos que podían verse procedían de la desintegración de átomos de radio, de las partículas alfa que cada uno emitía al explotar. Nadie habría imaginado, dijo el tío Abe, que seríamos capaces de ver los efectos de átomos individuales, y mucho menos de poder contarlos uno por uno.
—Aquí hay menos de una millonésima de miligramo de radio, y no obstante, en la pequeña zona de la pantalla, hay docenas de destellos por segundo. Imagina cuántas habría en un gramo de radio: mil millones de veces esa cantidad.
—Cien mil millones —calculé.
—Más —dijo el tío Abe—. Ciento treinta y seis mil millones, para ser exactos: el número no varía nunca. Cada segundo, ciento treinta y seis mil millones de átomos de un gramo de radio se desintegran, emiten sus partículas alfa, y si piensas que eso ha ocurrido durante miles de años, te harás una idea de la cantidad de átomos que hay en un solo gramo de radio.
Los experimentos llevados a cabo a principios de siglo habían demostrado que no sólo se emitían rayos alfa, sino también de muchos otros tipos. Casi todos los fenómenos de la radiactividad podían atribuirse a esos distintos tipos de rayos: la capacidad de ionizar el aire era sobre todo prerrogativa de los rayos alfa, mientras que la capacidad de provocar fluorescencia o afectar a las placas fotográficas era más notable con los rayos beta. Todos los elementos radiactivos poseían sus propias emisiones características: así, los preparados de radio emitían rayos alfa y beta, mientras que los de polonio emitían sólo rayos alfa. El uranio afectaba a una placa fotográfica más rápidamente que el torio, pero el torio era más potente a la hora de descargar un electroscopio.
Las partículas alfa emitidas por descomposición radiactiva (luego se demostró que eran núcleos de helio) estaban cargadas positivamente y eran bastante grandes —miles de veces más grandes que las partículas beta o los electrones—, y viajaban en líneas perfectamente rectas, atravesando la materia, haciendo caso omiso de ella, sin desviarse ni dispersarse (aunque sí podían perder parte de su velocidad en el proceso). Eso era, al menos, lo que parecía, aunque en 1906 Rutherford observó que muy de vez en cuando podía haber leves desviaciones. Otros pasaron el hecho por alto, pero para Rutherford eso podía ser importante. ¿No serían las partículas alfa proyectiles ideales, proyectiles de proporciones atómicas, con los que bombardear otros átomos y sondear su estructura? Les pidió a su joven ayudante, Hans Geiger, y a un estudiante, Ernest Marsden, que realizaran un experimento de destellos, utilizando como pantallas finas láminas metálicas, para así poder contar todas las partículas alfa que impactaran en ellas. Al disparar las partículas alfa contra una lámina de oro, descubrieron que más o menos una de cada ocho mil mostraba una importante desviación: de más de 90 grados, y a veces hasta 180. Rutherford afirmaría posteriormente: «Fue el suceso más increíble que me ha ocurrido en la vida. Era casi tan increíble como disparar un proyectil de trescientos ochenta milímetros contra un papel de seda y que rebotara y te diera a ti.»
Rutherford estuvo reflexionando sobre esos resultados durante casi un año, hasta que un día, como anotó Geiger, «entró en mi cuarto, de un humor excelente, y me dijo que ahora sabía cómo era un átomo y qué significaban esos extraños desvíos».
Los átomos, comprendió Rutherford, no eran una gelatina de masa positiva con electrones como pasas (tal como había sugerido J. J. Thomson en su modelo de átomo, donde lo comparaba a un «pudin de pasas»), pues entonces las partículas alfa siempre los atravesarían. Dada la gran energía y carga de esas partículas alfa, había que suponer que de vez en cuando eran desviadas por algo de mayor carga positiva que ellas. No obstante, eso sólo ocurría una vez de cada ocho mil. Las otras 7.999 partículas podían pasar a través del átomo de oro, como si éste fuera un espacio vacío; pero la que hacía ocho mil se detenía y volvía sobre su propia trayectoria, como una pelota de tenis que diera en una pared de tungsteno sólido. La masa del átomo de oro, infirió Rutherford, tenía que concentrarse en el centro, en un espacio diminuto, difícil de acertar: un núcleo de densidad casi inconcebible. El átomo, propuso, debía de consistir casi completamente en un espacio vacío, con un núcleo denso de carga positiva y de sólo una cienmilésima parte de su diámetro, con unos electrones de carga negativa y relativamente escasos en órbita en torno a ese núcleo: un sistema solar en miniatura, de hecho.
Los experimentos de Rutherford, su modelo nuclear de átomo, proporcionaron una base estructural que explicaba las enormes diferencias entre los procesos químicos y radiactivos, y la abismal diferencia de energía de cada uno (Soddy, en sus siempre concurridas conferencias, lo teatralizaba sosteniendo en una mano un tarro de medio kilo de uranio; lo levantaba y decía que eso tenía la energía de sesenta toneladas de carbón).
El cambio químico o la ionización implicaban que se ganaba o se perdía un electrón o dos, y eso requería sólo una modesta energía de dos o tres electrones voltio, que se podía producir fácilmente mediante una reacción química, el calor, la luz o una sencilla pila de tres voltios. Pero los procesos radiactivos afectaban al núcleo de los átomos, y puesto que éstos se mantenían unidos por fuerzas mucho mayores, su desintegración podía liberar energías de mucho mayor magnitud: algunos millones de electrones voltio.
Soddy acuñó el término energía atómica poco después de comenzar el siglo XX, diez años o más antes de que se descubriera el núcleo. Nadie sabía, ni había sido capaz de imaginar de una manera remotamente plausible, cómo el sol y las estrellas eran capaces de irradiar tanta energía y seguir haciéndolo durante millones de años. La energía química sería absurdamente inadecuada: un sol hecho de carbón se consumiría a los diez mil años. ¿Podría la radiactividad, la energía atómica, ser la respuesta?
Suponiendo [escribió Soddy]… que nuestro sol… estuviera hecho de puro radio… no habría ninguna dificultad en explicar su emanación de energía.
Soddy se preguntó si la transmutación, que se da de manera natural en sustancias radiactivas, podría producirse artificialmente.[87] Esa idea le transportó a alturas extáticas, milenaristas, casi místicas:
El radio nos ha enseñado que la cantidad de energía del mundo no tiene límites… Una raza que pudiera transmutar la materia tendría poca necesidad de ganarse el pan con el sudor de su frente… Esa raza podría transformar un continente desierto, descongelar los polos y convertir el mundo en un sonriente Jardín del Edén… Se han abierto posibilidades completamente nuevas. La herencia del hombre ha aumentado, sus aspiraciones se han elevado y su destino se ha ennoblecido hasta un punto que hoy día ya no podemos predecir… Un día obtendrá el poder de regular para sus propios fines las fuentes primarias de energía que la naturaleza conserva tan celosamente para el futuro.
Leí La interpretación del radio de Soddy el último año de la guerra, y me cautivó su idea de la energía inagotable, la luz infinita. Las embriagadoras palabras de Soddy me transmitieron esa sensación de ebriedad, esa sensación de poder y salvación, que habían acompañado al descubrimiento del radio y la radiactividad a principios de siglo.
Pero además de todo eso, Soddy también expresaba las perspectivas más sombrías, que, de hecho, había tenido presentes casi desde el principio, y, ya en 1903, había afirmado que la tierra era un «polvorín lleno de explosivos, inconcebiblemente más poderosos que todos los que conocemos». Esta nota de advertencia aparece a menudo en La interpretación del radio, y fue la poderosa imagen de Soddy la que inspiró a H. G. Wells para que regresara a la ciencia ficción que había practicado al inicio de su carrera y publicara, en 1914, El mundo liberado (Wells de hecho dedicó su libro a La interpretación del radio). En el libro Wells concebía un nuevo elemento radiactivo llamado carolino, que liberaba energía casi como una reacción en cadena.[88]
Anteriormente, durante las guerras, la explosión de los proyectiles y los cohetes habían durado un momento, estallaban en un instante y ya estaba… pero el carolino… una vez se había iniciado su proceso degenerativo, seguía emitiendo una furiosa radiación de energía que nada podía parar.
Me acordé de las profecías de Soddy, y de las de Wells, en agosto de 1945, cuando nos enteramos de las noticias de Hiroshima. La bomba atómica me provocó sentimientos extrañamente contradictorios. Nuestra guerra, después de todo, había acabado, Alemania ya se había rendido; contrariamente a los estadounidenses, no habíamos sufrido lo de Pearl Harbour, y habíamos combatido (dejando aparte las campañas en Malasia y Birmania) mucho menos con los japoneses. Las bombas atómicas, en cierto modo, eran como un terrible epílogo a la guerra, una espantosa demostración que quizá no era necesaria.
No obstante, también, al igual que muchos, sentía júbilo ante el logro científico de dividir el átomo, y me entusiasmó el Informe Smyth, publicado en agosto de 1945, que daba una completa descripción de la bomba. Pero no comprendí todo el horror de la bomba hasta el verano siguiente, cuando el artículo «Hiroshima», de John Hersey, fue publicado en una edición especial de The New Yorker que sólo contenía ese artículo (se decía que Einstein había comprado mil ejemplares de la revista) y poco después fue retransmitido por la BBC en su Tercer Programa. Hasta ese momento, la química y la física habían sido para mí una fuente de puro disfrute y asombro, y quizá no era lo suficientemente consciente de sus poderes negativos. Las bombas atómicas me afectaron profundamente, igual que a todo el mundo. Uno tenía la impresión de que la física atómica o nuclear jamás podría recuperar la inocencia y despreocupación que había tenido en los días de Rutherford y los Curie.