16. EL JARDÍN DE MENDELÉIEV
En 1945 volvió a abrirse el Museo de la Ciencia de South Kensington, que había permanecido cerrado durante gran parte de la guerra, y vi por primera vez la gigantesca tabla periódica que allí se exhibía. La propia tabla, que ocupaba toda una pared en lo alto de las escaleras, era una vitrina de madera oscura con noventa y pico cubículos, y en cada uno estaba grabado el nombre, la masa atómica y el símbolo químico de su elemento. Y en cada cubículo había una muestra del propio elemento (de todos los elementos, cuando menos, que se habían obtenido en forma pura y podían exhibirse de manera segura). Le habían puesto el rótulo de «La clasificación periódica de los elementos, según Mendeléiev».
Lo primero que vi fueron los metales, docenas de metales en todas las formas posibles: varillas, terrones, cubos, alambres, láminas, discos, cristales. Casi todos eran grises o plateados, y algunos mostraban indicios de azul o rosa. Algunos poseían una superficie bruñida que brillaba con un tenue amarillo, y luego estaban los vivos colores del cobre y el oro.
En la esquina superior derecha estaban los no metales: el azufre, con sus espectaculares cristales amarillos, y los cristales rojos y traslúcidos del selenio; el fósforo, parecido a la cera de abeja de color pálido, que permanecía sumergido en agua; y el carbono, en forma de diminutos diamantes y de reluciente grafito negro. Había boro, un polvo marronoso, silicio en cristales que formaban caballones, con un vivo lustre negro parecido al grafito o la galena.
A la izquierda estaban los metales alcalinos y alcalinotérreos —los metales de Humphry Davy—, todos, a excepción del magnesio, en baños protectores de nafta. Me sorprendió ver el litio en la esquina superior, pues éste, con su ligereza, flotaba sobre la nafta, y también el cesio, más abajo, que formaba un reluciente charco debajo de la nafta. Sabía que el cesio tenía un punto de fusión muy bajo, y aquél era un caluroso día de verano. Pero no me había dado cuenta del todo, a partir de los terrones diminutos y parcialmente oxidados que había visto, de que el cesio puro tenía un pálido color dorado, y que al principio le daba un brillo, un destello de oro, una especie de iridiscencia de lustre áureo; pero luego, desde un ángulo inferior, era puro oro, y parecía un mar áureo, o mercurio dorado.
Había otros elementos que hasta entonces sólo había conocido de nombre (o que, de manera igualmente abstracta, para mí no eran más que nombres aparejados a propiedades físicas y masas atómicas), y ahora, por primera vez, los veía en toda su realidad y diversidad. Aquella primera y sensual mirada a la tabla periódica fue para mí un glorioso banquete, una mesa inmensa en la que se ordenaban ochenta y pico platos distintos.
En aquella época estaba familiarizado con las propiedades de muchos elementos, y sabía que formaban familias naturales, tales como los metales alcalinos, los metales de tierras alcalinas, y los halógenos. Estas familias (Mendeléiev los llamaba «grupos») formaban las columnas verticales de la tabla: los metales alcalinos y los alcalinotérreos a la izquierda, los halógenos y los gases inertes a la derecha, y todos los demás en cuatro grupos intermedios en medio. La manera en que se formaban esos grupos intermedios era un tanto menos clara; así, en el Grupo VI, vi el azufre, el selenio y el telurio. Sabía que esos tres (mis «apestógenos») eran muy parecidos, pero ¿por qué el oxígeno encabezaba el grupo? Debía de existir un principio más profundo… y de hecho así era. Estaba impreso en lo alto de la tabla, pero en mi impaciencia por ver los elementos, no le había prestado atención. Vi que el principio más profundo era la valencia. El término valencia no aparecía en mis libros de la época victoriana, pues el concepto no se había desarrollado hasta finales de la década de 1850, y Mendeléiev fue uno de los primeros en apropiárselo y utilizarlo como base para su clasificación, para proporcionar lo que nunca había estado claro anteriormente: una base racional que explicara el hecho de que los elementos parecieran formar familias naturales, poseer profundas analogías químicas y físicas uno con otro. Mendeléiev reconocía ahora ocho grupos de elementos en términos de sus valencias.
Así, los elementos del Grupo I, los metales alcalinos, tenían una valencia de 1: un átomo de ellos se combinaba con un átomo de hidrógeno para formar compuestos como LiH, NaH, KH, etcétera. (O con un átomo de cloro para formar compuestos como LiCl, NaCl o KCl). Los elementos del Grupo II, los metales alcalinotérreos, tenían una valencia 2, y formaban compuestos como CaCl2, SrCl2, BaCl2, etcétera. Los elementos del Grupo VIII tenían una capacidad combinatoria máxima de 8.
Pero al tiempo que Mendeléiev organizaba los elementos según sus valencias, también se sentía fascinado por sus masas atómicas, y por el hecho de que fueran únicos y específicos para cada elemento. Y si, mentalmente, comenzó a clasificar los elementos según sus valencias, lo mismo hizo con las masas atómicas. Pues si disponía los elementos simplemente siguiendo el orden de sus masas atómicas, en «períodos» horizontales, como él los llamaba, veía cómo las mismas propiedades y valencias se repetían a intervalos regulares.
Cada elemento se hacía eco de las propiedades del que tenía encima, era un miembro de la misma familia, sólo que un poco más pesado. La misma melodía, por así decir, se interpretaba en cada período —primero un metal alcalino, luego uno alcalinotérreo, luego seis elementos más, cada uno con su propia valencia o tono—, aunque en un registro diferente (era imposible no pensar en octavas y escalas, pues yo vivía en una casa llena de música, y las escalas eran la periodicidad que oía cada día).
Era el número ocho el que dominaba la tabla periódica que tenía ante mí, aunque uno pudiera ver, en la parte inferior de la misma, que algunos elementos extra se introducían dentro de los octetos básicos: diez elementos extra en los períodos 4 y 5, y diez más catorce en el período 6.
A medida que uno ascendía, cada período se completaba y conducía al siguiente en una serie de mareantes curvas, o al menos ésa fue la forma que asumió en mi imaginación, que transformó la sobria tabla rectangular en espirales y curvas. La tabla era una especie de escalera cósmica o una escalera de Jacob, que subía y bajaba de un cielo pitagórico.
De pronto comprendí lo asombrosa que debió de parecerles la tabla periódica a los primeros que la vieron: químicos que conocían perfectamente siete u ocho familias químicas, pero que nunca habían comprendido la base de esas familias (la valencia), ni cómo todas ellas podían agruparse en un solo esquema global. Me pregunté si habrían reaccionado igual que yo ante esa revelación: «¡Claro! ¡Es obvio! ¿Por qué no se me ocurrió antes?»
Pensara uno en términos de las columnas horizontales o de las verticales, tanto daba: de un modo u otro se llegaba a la misma cuadrícula. Era como un crucigrama al que había que acercarse por las claves horizontales o verticales, sólo que un crucigrama era algo arbitrario, una elaboración puramente humana, mientras que la tabla periódica reflejaba un profundo orden de la naturaleza, pues mostraba todos los elementos dispuestos en una relación fundamental. Tuve la sensación de que albergaba un maravilloso secreto, pero era un criptograma sin clave alguna: ¿por qué era así esa relación?
Aquella noche casi no pude dormir de excitación: me parecía un logro increíble haber conseguido imponer sobre todo el vasto y aparentemente caótico universo un orden del que nada escapaba. Las primeras clarificaciones intelectuales importantes habían ocurrido con la definición de los elementos de Lavoisier, cuando Proust había descubierto que los elementos se combinaban únicamente en proporciones discretas, y con la idea de Dalton de que los elementos estaban compuestos de átomos cuya masa atómica era única. Con todo ello, la química había alcanzado su mayoría de edad, y se había convertido en la química de los elementos. Pero nadie había visto que los elementos mismos aparecieran en ningún orden; sólo se podían enumerar alfabéticamente (tal como había hecho Pepper en su Playbook of Metals) o según familias o grupos aislados. Ninguna otra cosa era posible hasta el descubrimiento de Mendeléiev. Haber intuido una organización global, un principio que abarcara, uniera y relacionara todos los elementos, era algo milagroso, la obra de un genio. Y eso, por primera vez, me hizo ver el poder trascendente de la mente humana, y el hecho de que podía estar preparada para descubrir o descifrar los más profundos secretos de la naturaleza, para leer la mente de Dios.
Aquella noche, en mi nervioso duermevela, seguí soñando con la tabla periódica: aparecía en mis sueños como una girándula o un molinillo, destellante y sin parar de girar, y a continuación era una gran nebulosa que iba del primer al último elemento, y que luego seguía girando más allá del uranio, hasta el infinito. Al día siguiente llegué al museo antes de que abrieran, y en cuanto me dejaron entrar fui corriendo al piso de arriba a ver la tabla.
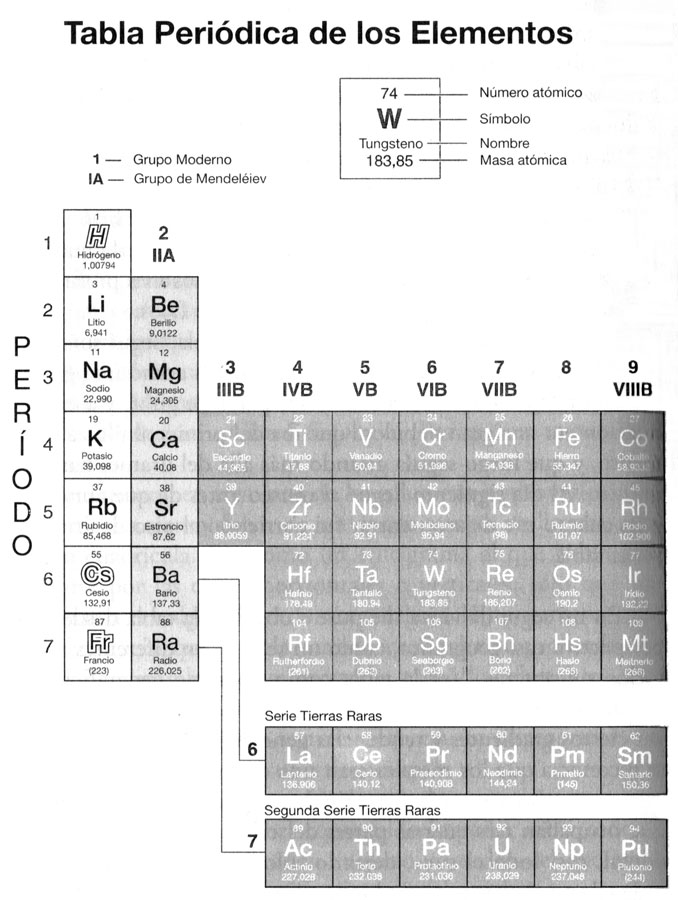
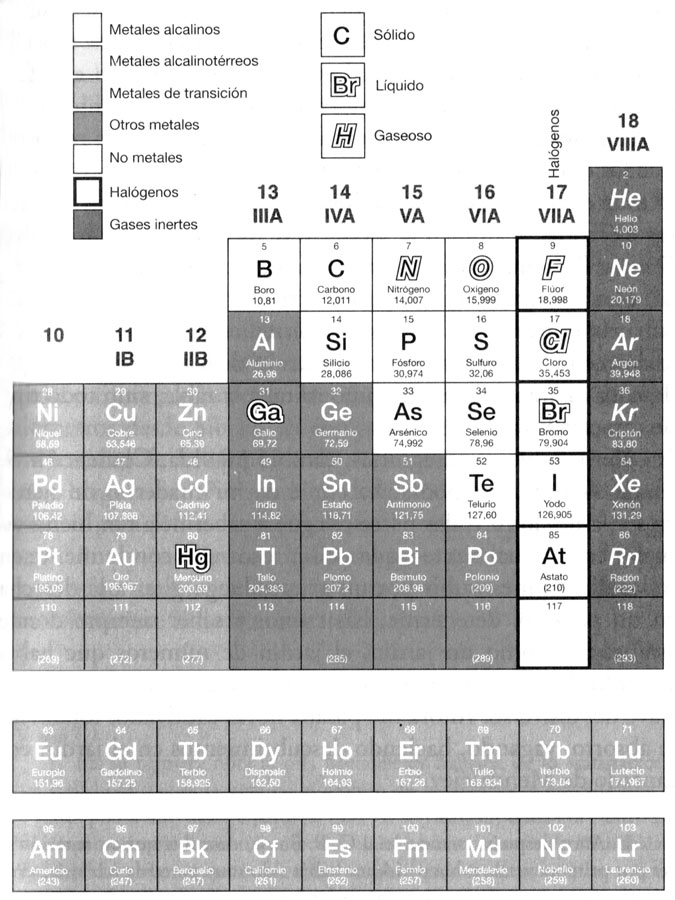
En mi segunda visita me puse a observar la tabla desde una perspectiva casi geográfica, como un reino, con diferentes territorios y fronteras. Ver la tabla como un reino geográfico me permitió colocarme por encima de los elementos individuales y ver ciertos gradientes y tendencias generales. Hacía tiempo que se reconocía que los metales eran una categoría especial de elementos, y ahora se veía, a partir de una sola ojeada sinóptica, que ocupaban tres cuartas partes del reino —toda la zona occidental, casi todo el sur—, dejando sólo una pequeña área, casi toda ella en el noreste, para los no metales. Una línea quebrada, como el muro de Adriano, separaba los metales del resto, y unos pocos «semimetales», metaloides —arsénico, selenio—, quedaban a horcajadas sobre el muro. Se veían los gradientes de ácido y base, cómo los óxidos de los elementos «occidentales» reaccionaban con el agua para formar álcalis, y los óxidos de los elementos «orientales», casi todos no metales, para formar ácidos. Uno podía ver, de nuevo de una sola ojeada, cómo los elementos de las dos fronteras del reino —los metales alcalinos y los halógenos, como el sodio o el cloro, por ejemplo— mostraban gran avidez el uno por el otro y se combinaban con una fuerza explosiva, formando sales cristalinas con un punto de fusión elevado, que se disolvían para formar electrolitos; mientras que los que estaban en el medio formaban un tipo de compuesto muy distinto: líquidos volátiles o gases que resistían las corrientes eléctricas. También se podía ver, recordando cómo Volta, Davy y Berzelius clasificaban los elementos en una serie eléctrica, cómo los elementos más fuertemente electropositivos quedaban a la izquierda, y los más fuertemente electronegativos a la derecha. Así, no era sólo la ubicación de los elementos lo que llamaba la atención cuando uno miraba la tabla, sino todo tipo de características.
Ver la tabla, «conseguida», cambió mi vida. Comencé a visitarla siempre que podía. La copié en mi cuaderno de ejercicios y la llevaba a todas partes; llegué a sabérmela tan bien —visual y conceptualmente— que podía recorrerla con la mente en todas direcciones, subir por un grupo, luego girar a la derecha en un período, detenerme, bajar uno, y saber siempre donde estaba. Era como un jardín, el jardín de números que había adorado de pequeño, pero contrariamente a ése, éste era real, la clave del universo. Ahora me pasaba horas cautivado, totalmente absorto, vagando, haciendo descubrimientos en el jardín encantado de Mendeléiev.[56]
En el museo había una foto de Mendeléiev junto a la tabla periódica; parecía un cruce entre Fagin y Svengali,[57] con una enorme mata de pelo y barba, y unos ojos hipnóticos y penetrantes. Una figura salvaje, extravagante, bárbara, pero tan romántica, a su manera, como el byroniano Humphry Davy. Quería saber más de él, y leer sus famosos Principios, en los que había publicado por primera vez su tabla periódica.
Su libro, su vida, no me decepcionaron. Era un hombre de intereses enciclopédicos. También le encantaba la música, y era amigo íntimo de Borodin (que también era químico). Y era el autor del texto sobre química más delicioso y vivo que se había publicado, Los principios de química.[58]
Al igual que mis padres, Mendeléiev procedía de una gran familia: él era el menor de catorce hermanos. Su madre debió de reconocer su precoz inteligencia, y cuando Mendeléiev cumplió catorce años, dándose cuenta de que el muchacho estaría perdido sin una educación adecuada, la mujer recorrió miles de kilómetros desde Siberia en compañía de su hijo, primero a la Universidad de Moscú (donde no le quisieron por ser siberiano) y luego a San Petersburgo, donde consiguió una beca para estudiar para profesor. (La madre, al parecer, que tenía casi sesenta años en esa época, murió de agotamiento tras ese prodigioso esfuerzo. Mendeléiev, que sentía un gran cariño por ella, posteriormente le dedicaría sus Principios.)
Ya siendo estudiante en San Petersburgo, Mendeléiev mostró no sólo una insaciable curiosidad, sino un ansia de organizar principios de todo tipo. Linneo, en el siglo XVIII, había clasificado las plantas y los animales, y (de manera mucho menos satisfactoria) también los minerales. Dana, en la década de 1830, había sustituido la antigua clasificación de los minerales por una clasificación química formada por aproximadamente una docena de categorías principales (elementos nativos, óxidos, sulfuros, etcétera). Pero los elementos en sí mismos no habían sido clasificados de ninguna manera, y en aquel momento se conocían unos sesenta. Algunos elementos, de hecho, eran imposibles de clasificar. ¿Dónde iba el uranio, o ese desconcertante metal ultraligero, el berilio? Algunos de los elementos descubiertos más recientemente eran en especial difíciles: el talio, por ejemplo, descubierto en 1862, era en ciertos aspectos similar al plomo, en otros a la plata, en otros al aluminio y en otros al potasio.
Pasaron casi veinte años desde que Mendeléiev comenzara a interesarse por la clasificación hasta la aparición de su tabla periódica en 1869. El hecho de que pasara tanto tiempo meditando e incubando la idea (de manera muy parecida a como hizo Darwin antes de publicar El origen de las especies) fue quizá la razón por la que, cuando Mendeléiev publicó finalmente sus Principios, proporcionó un conocimiento y una comprensión mucho mayor que cualquiera de sus contemporáneos, algunos de los cuales veían claramente la periodicidad, aunque ninguno fuera capaz de ordenarlos con el asombroso detalle de Mendeléiev.
Mendeléiev relataba que anotaba las propiedades y masas atómicas de los elementos en fichas y cavilaba y las barajaba constantemente durante sus largos viajes en tren por toda Rusia, haciendo (tal como él los llamaba) «solitarios químicos», intentando encontrar un orden, un sistema que permitiera explicar todos los elementos, sus propiedades y masas atómicas.
Había otro hecho fundamental. Durante décadas, no había habido acuerdo acerca de las masas atómicas de muchos elementos. Sólo cuando finalmente se aclaró esto, en el congreso de Karlsruhe de 1860, Mendeléiev y otros pudieron comenzar a pensar en conseguir una completa taxonomía de los elementos. Mendeléiev había ido a Karlsruhe con Borodin (se trataba de un viaje musical además de químico, pues de camino se detuvieron en muchas iglesias y probaron los órganos por sí mismos). Con las masas atómicas anteriores al congreso de Karlsruhe, se podía ver que existían tríadas o grupos, pero no que hubiera ninguna relación numérica entre los propios grupos.[59] Sólo cuando Cannizzaro mostró cómo obtener masas atómicas fiables y que, por ejemplo, las verdaderas masas atómicas de los metales alcalinotérreos (calcio, estroncio y bario) eran 40, 88 Y 137 (y no 20, 44 y 68, como se creía), quedó claro lo estrechamente emparentados que estaban estos metales con los alcalinos: el potasio, el rubidio y el cesio. Era esta proximidad, y también la semejanza de las masas atómicas de los halógenos —cloro, bromo y yodo—, lo que impulsó a Mendeléiev, en 1868, a hacer una yuxtaposición de los tres grupos:
| Cl | 35,5 | K | 39 | Ca | 40 |
| Br | 80 | Rb | 85 | Sr | 88 |
| I | 127 | Cs | 133 | Ba | 137 |
Y fue en ese momento, al ver que la ordenación de los tres grupos de elementos siguiendo el orden de su masa atómica producía una estructura repetitiva —un halógeno seguido de un metal alcalino, y después un metal alcalinotérreo—, cuando Mendeléiev, intuyendo que eso debía de formar parte de una estructura más amplia, dio el salto a la idea de que existía una periodicidad que gobernaba todos los elementos: una Ley Periódica.
Mendeléiev se puso a rellenar su primera tabla periódica, y a continuación la extendió en todas direcciones, como quien llena un crucigrama, lo que requirió algunas atrevidas suposiciones. ¿Qué elemento, se preguntó, estaba químicamente emparentado con los metales alcalinotérreos, e iba detrás del litio en masa atómica? Al parecer, dicho elemento no existía… ¿o sería el berilio, generalmente considerado trivalente, y con una masa atómica de 14,5? ¿Y si en realidad fuera bivalente, y su masa atómica no fuera de 14,5, sino de 9? Entonces iría detrás del litio y encajaría perfectamente en el espacio vacío.
Alternando los cálculos y las corazonadas, moviéndose entre la intuición y el análisis, a las pocas semanas Mendeléiev había tabulado treinta y pico elementos en orden de menor a mayor masa atómica, una tabulación que ahora sugería que había una repetición de propiedades cada ocho elementos. Y se cuenta que en la noche del 16 de febrero de 1869 tuvo un sueño en el que vio casi todos los elementos conocidos dispuestos en una gran tabla. A la mañana siguiente la reprodujo sobre el papel.[60]
La pauta y la lógica de la tabla de Mendeléiev eran tan claras que algunas anomalías destacaban de inmediato. Algunos elementos parecían estar en el lugar equivocado, mientras que había lugares que carecían de elemento. Basándose en sus enormes conocimientos químicos, reubicó media docena de elementos, desafiando las valencias y masas atómicas entonces aceptadas. Con ello, demostró una audacia que escandalizó a sus contemporáneos (Lothar Meyer, por ejemplo, consideró que era monstruoso cambiar las masas atómicas simplemente porque no «encajaban»).
En un acto de suprema seguridad en sí mismo, Mendeléiev reservó varios espacios de su tabla para elementos «todavía desconocidos». Afirmó que extrapolando las propiedades de los elementos que había encima y debajo (y también, hasta cierto punto, de los que había al lado), se podía hacer una predicción fiable de cómo serían esos elementos desconocidos. Fue exactamente lo que hizo en la tabla de 1871, prediciendo con gran detalle un nuevo elemento (el «eka-aluminio») que iría debajo del aluminio en el Grupo III. Cuatro años después, el químico francés Lecoq de Boisbaudran descubrió ese elemento, y lo llamó (ya fuera por patriotismo o en sutil referencia a sí mismo, gallus, el gallo) galio.
La exactitud de la predicción de Mendeléiev fue asombrosa: predijo una masa atómica de 68 (Lecoq obtuvo 69,9) y una gravedad específica de 5,9 (Lecoq obtuvo 5,94), y adivinó un gran número de propiedades físicas y químicas del galio: su fusibilidad, sus óxidos, sus sales, su valencia. Hubo algunas discrepancias iniciales entre las observaciones de Lecoq y las predicciones de Mendeléiev, pero todas ellas se resolvieron rápidamente a favor de Mendeléiev. De hecho, se decía que Mendeléiev conocía mejor las propiedades del galio —un elemento que nunca había visto— que el hombre que lo descubrió.
De pronto, Mendeléiev dejó de ser visto como un mero conjeturador o soñador, y se convirtió en alguien que había descubierto una ley básica de la naturaleza, y la tabla periódica dejó de ser un bonito esquema sin demostrar para convertirse en una guía inapreciable que permitía coordinar una inmensa cantidad de información química que antes no guardaba relación alguna. También podía utilizarse para sugerir numerosas investigaciones en el futuro, incluyendo una búsqueda sistemática de los elementos que «faltaban». «Antes de la divulgación de esta ley», diría Mendeléiev veinte años después, «los elementos químicos se consideraban meros hechos fragmentarios e incidentales de la naturaleza; no había ninguna razón especial que augurara el descubrimiento de nuevos elementos.»
Ahora, con la tabla periódica de Mendeléiev, uno no sólo podía esperar su descubrimiento, sino predecir sus propiedades. Mendeléiev hizo dos predicciones más igualmente minuciosas, que fueron también confirmadas con el descubrimiento del escandio y el germanio unos años después.[61] Al igual que con el galio, hizo sus predicciones basándose en la analogía y la linealidad, suponiendo que las propiedades físicas y químicas de estos elementos desconocidos, y sus masas atómicas, estarían entre las de sus elementos vecinos en los grupos verticales.[62]
La piedra angular de toda la tabla, curiosamente, no fue prevista por Mendeléiev, y quizá era imposible que lo hiciera, pues no se trataba de que faltara un elemento, sino toda una familia o grupo. Cuando en 1894 se descubrió el argón —un elemento que parecía no encajar en ningún lugar de la tabla—, Mendeléiev negó al principio que pudiera ser un elemento, y pensó que era una forma de nitrógeno más pesada (N3 análogo al ozono, O3). Pero entonces se vio que sí había sitio para el nuevo elemento, justo entre el cloro y el potasio, y que de hecho cabía un grupo entero entre los halógenos y los metales alcalinos en cada período. Esto también lo vio Lecoq, quien predijo las masas atómicas de los demás gases aún por descubrir, lo cual, de hecho, sucedió rápidamente. Con el descubrimiento del helio, el neón, el criptón y el xenón, estaba claro que esos gases constituían un perfecto grupo periódico, un grupo tan inerte, tan modesto, tan discreto, que había eludido la atención de la química durante cien años.[63] Los gases inertes eran idénticos en su incapacidad para formar compuestos; su valencia, al parecer, era cero.[64]
La tabla periódica era increíblemente hermosa, lo más hermoso que yo había visto. Jamás pude analizar de manera adecuada lo que yo quería dar a entender por belleza en este caso: ¿simplicidad?, ¿coherencia?, ¿ritmo?, ¿inevitabilidad? O quizá se trataba de la simetría, del hecho de que cada elemento quedara firmemente encerrado en su lugar, sin huecos ni excepciones, de que todo implicara la existencia de todo.
Me molestó que un químico inmensamente erudito, J. W. Mellor, cuyo extenso tratado sobre química inorgánica yo había comenzado a hojear, tachara la tabla periódica de «superficial» e «ilusoria», y dijera que no era más cierta ni más fundamental que cualquier otra clasificación ad hoc. Eso me hundió en un breve período de pánico, hizo que resultara imperativo para mí ver que la idea de la periodicidad no sólo se sustentaba en el carácter químico y la valencia.
Para investigarlo tuve que salir de mi laboratorio, y acudí a un libro recién publicado que de inmediato se convirtió en mi biblia: el Manual CRC de física y química, un grueso libro, casi cúbico, de cerca de tres mil páginas, que contenía tablas de todas las propiedades físicas y químicas imaginables, muchas de las cuales me aprendí de manera obsesiva.
Me aprendí las densidades, puntos de fusión, puntos de ebullición, índices de refracción, solubilidades y formas cristalinas de todos los elementos y de cientos de compuestos. Dedicaba todas mis energías a trazar gráficos de todas esas propiedades, poniendo las masas atómicas en las ordenadas y en las abscisas todas las propiedades físicas que se me ocurrían. Cada vez estaba más entusiasmado, más eufórico, pues allí donde mirara siempre encontraba periodicidad: no sólo la densidad, el punto de fusión, el punto de ebullición, sino la conductividad del calor y la electricidad, la forma cristalina, la dureza, los cambios de volumen durante la fusión, la expansión por el calor, los potenciales de electrodo, etcétera. No se trataba sólo de la valencia, entonces, sino también de las propiedades químicas. Esta confirmación incrementó para mí el poder, la universalidad de la tabla periódica.
Había excepciones a las tendencias que aparecían en la tabla periódica, y también anomalías, algunas de ellas profundas. ¿Por qué, por ejemplo, era el manganeso un mal conductor eléctrico, cuando los elementos que tenía a cada lado eran conductores bastante buenos? ¿Por qué sólo los metales de hierro poseían un fuerte magnetismo? Sin embargo, yo estaba convencido de que esas excepciones reflejaban la existencia de mecanismos adicionales, y que de ningún modo invalidaban el sistema global.[65]
Intenté hacer mis propias predicciones sirviéndome de la tabla periódica: las propiedades de un par de elementos aún desconocidos, al igual que Mendeléiev había hecho con el galio y otros elementos. La primera vez que vi la tabla del museo observé que había en ella cuatro huecos. El último de los metales alcalinos, el elemento 87, aún faltaba, al igual que el último de los halógenos, el 85. El elemento 43, el que estaba debajo del manganeso, también faltaba, aunque en su lugar se leía «¿Masurio?» y no había masa atómica.[66] Finalmente también faltaba una tierra rara, el elemento 61.
Era fácil predecir las propiedades del metal alcalino, pues los metales alcalinos eran todos muy parecidos, y sólo había que extrapolarlas de los demás elementos del grupo. Calculé que el 87 sería el más pesado, el más fusible, el más reactivo de todos; sería un líquido a temperatura ambiente, y, como el cesio, tendría un lustre dorado. De hecho, también podría ser color salmón, igual que el cobre fundido. Sería más electropositivo que el cesio, y mostraría un efecto fotoeléctrico aún mayor. Al igual que los demás metales alcalinos, les daría a las llamas un color asombroso, probablemente un color azulado, pues los colores de las llamas desde el litio hasta el cesio tendían a ese color.
Igualmente fácil fue predecir las propiedades del halógeno desconocido, pues los halógenos también eran muy parecidos, y el grupo mostraba rasgos sencillos y lineales.
Pero más peliagudo sería predecir las propiedades del elemento 43 y del 61, pues eran elementos no «típicos» (en palabras de Mendeléiev). Y era precisamente con esos elementos no típicos con los que Mendeléiev había tenido problemas, obligándole a revisar su tabla original. Los metales de transición poseían una especie de homogeneidad. Todos eran metales, los treinta, y casi todos, como el hierro, eran duros y resistentes, densos e infusibles. Y ello ocurría de manera especial con los pesados elementos de transición, como el platino y sus metales asociados y los metales filamentosos que el tío Dave me había enseñado. Mi interés por el color me había hecho comprender otro hecho, que mientras que los componentes de los elementos típicos carecían generalmente de color, como la sal común, los compuestos de los metales de transición poseían vivos colores: los minerales color rosa de las sales de manganeso y cobalto, el verde de las sales de cobre y níquel, los muchos colores del vanadio; y además de muchos colores tenían muchas valencias. Todas estas propiedades me hicieron ver que los metales de transición eran un tipo de animal especial, de otra naturaleza que los elementos típicos.
Sin embargo, se podía aventurar la hipótesis de que el elemento 43 tendría algunas de las características del manganeso y el renio, los demás metales del grupo (por ejemplo, tendría una valencia máxima de 7, y formaría sales de colores); pero también sería genéricamente parecido a los vecinos metales de transición de su período: el niobio y el molibdeno a la izquierda, y los metales ligeros de platino a la derecha. De modo que se podía predecir que tendríamos un metal brillante, duro, plateado, de una densidad y punto de fusión parecidos a los de aquéllos. Sería justo el tipo de metal que adoraba el tío Tungsteno, y justo el tipo de metal que habría sido descubierto por Scheele en la década de 1770… si existía, es decir, en cantidades apreciables.
Lo más difícil sería predecir cualquier detalle del elemento 61, la tierra metálica rara que faltaba, pues esos elementos, en muchos aspectos, eran los más desconcertantes de todos.
La primera persona a la que oí hablar de las tierras raras fue mi madre, que fumaba como un carretero y encendía un cigarrillo tras otro con un pequeño mechero Ronson. Un día me enseñó la «piedra», sacándola, y me dijo que no era un verdadero pedernal, sino un metal que producía chispas cuando se rascaba. Este «mischmetal» —en su mayor parte cerio— era una aleación de media docena de metales distintos, todos ellos muy parecidos, y todos ellos tierras raras. Su extraño nombre, el de tierras raras, sonaba a algo mítico, a cuento de hadas, y me imaginé que las tierras raras no sólo serían raras y preciadas, sino que también poseerían una cualidad secreta y especial que nadie más compartiría.
Posteriormente el tío Dave me habló de la extraordinaria dificultad que habían encontrado los químicos en distinguir cada una de las tierras raras —había una docena o más—, pues eran increíblemente parecidas, a veces imposibles de distinguir por sus propiedades físicas y químicas. Sus menas (que, por alguna razón, parecían venir todas de Suecia) nunca contenían una sola tierra rara, sino un conglomerado, como si la propia naturaleza tuviera problemas para distinguirlas. Su análisis constituía toda una saga en la historia de la química, una saga de investigación apasionada (y con frecuencia frustración) en los cien años o más que se tardó en identificarlas. La separación de las últimas tierras raras, de hecho, desafió la capacidad de la química a lo largo de todo el siglo XIX, y fue sólo con el uso de métodos físicos como el espectroscopio y la cristalización fraccionada como finalmente se pudieron separar. No menos de quince mil cristalizaciones fraccionadas, en las que se aprovechaban las infinitesimales diferencias de solubilidad entre sus sales, se necesitaron para separar los dos últimos, el iterbio y el lutecio: una empresa que tardó años.
Sin embargo, hubo químicos que quedaron cautivados por las intransigentes tierras raras, y pasaron su vida entera intentado aislarlas, intuyendo que su estudio podría arrojar una inesperada luz sobre todos los elementos y sus periodicidades:
Las tierras raras [escribió William Crookes] nos frustran en nuestras investigaciones, nos desconciertan en nuestras especulaciones y nos obsesionan en nuestros sueños. Se extienden ante nosotros como un mar desconocido, burlándose, sumiéndonos en la perplejidad y farfullando extrañas revelaciones y posibilidades.
Si las tierras raras frustraban, desconcertaban y obsesionaban a los químicos, realmente enloquecieron a Mendeléiev en su esfuerzo por asignarles un lugar en su tabla periódica. Cuando elaboró su primera tabla, en 1869, sólo había cinco tierras raras, pero en las décadas siguientes se fueron descubriendo más y más, y con cada descubrimiento el problema se hacía mayor, pues todas ellas, con sus números atómicos consecutivos, pertenecían (al parecer) a un único lugar en la tabla, apretándose, por así decir, entre dos elementos adyacentes del período 6. Otros, de igual modo, se esforzaban por colocar elementos enloquecedoramente similares, y les frustraba la profunda incertidumbre de cuántas tierras raras acabarían encontrándose.
Muchos químicos, a finales del siglo XIX, sentían la tentación de colocar los elementos de transición y las tierras raras en «bloques» separados, pues se necesitaba una tabla periódica con más espacio, más dimensiones, para acomodar esos elementos «extra» que parecían interrumpir los ocho grupos básicos de la tabla. Yo mismo ensayé diferentes formas de la tabla periódica que permitieran acomodar esos bloques, probando con tablas en espiral o de tres dimensiones. Luego averigüé que muchos otros habían hecho lo mismo: en vida de Mendeléiev aparecieran más de cien versiones de la tabla.
Todas las tablas que yo había hecho, todas las que había visto, acababan en incertidumbre, con un interrogante que giraba en torno al «último» elemento, el uranio. El período 7 me llenaba de enorme curiosidad, pues comenzaba con el metal alcalino aún desconocido, el elemento 87, y llegaba hasta el uranio, el elemento 92. ¿Por qué, me preguntaba, debería detenerse aquí, después de sólo seis elementos? ¿Por qué no podía haber más elementos después del uranio?
El propio uranio había sido colocado por Mendeléiev debajo del tungsteno, que era el más pesado de los elementos de transición del Grupo VI, pues químicamente se parecía mucho al tungsteno. (El tungsteno formaba un hexafluoruro volátil, un vapor muy denso, igual que el uranio: este compuesto, el UF6, fue utilizado en la guerra para separar los isótopos del uranio.) El uranio parecía un metal de transición, parecía un eka-tungsteno, y sin embargo, seguía habiendo algo que me incomodaba, y decidí investigar un poco, examinar las densidades y puntos de fusión de todos los metales de transición. En cuanto lo hice descubrí una anomalía, pues si las densidades de los metales aumentaban de manera constante a través de los períodos 4, 5 y 6, declinaban inesperadamente cuando uno llegaba a los elementos del período 7. El uranio era de hecho menos denso que el tungsteno, aunque lo previsible fuera lo contrario (el torio, de manera similar, era menos denso que el hafnio, y no más, como habría sido de esperar). Lo mismo pasaba exactamente con sus puntos de fusión: alcanzaban un máximo en el período 6, y luego descendían de forma repentina.
Todo eso me llenó de excitación; creía haber hecho un descubrimiento. ¿Era posible que, a pesar de las semejanzas entre el uranio y el tungsteno, el uranio no perteneciera de hecho al mismo grupo, y que ni siquiera fuera un metal de transición? ¿Podría ocurrir también lo mismo con los demás elementos del período 7, el torio y el protactinio, y los elementos (imaginarios) que venían después del uranio? ¿Podría ser que esos elementos fueran, por el contrario, el inicio de una segunda serie de tierras raras, exactamente análoga a la primera del período 6? Si ése era el caso, entonces el eka-tungsteno no sería el uranio, sino un elemento aún por descubrir, que aparecería sólo después de que la segunda serie de tierras raras se hubiera completado. En 1945 eso era algo todavía inimaginable, aún ciencia ficción.
Poco después de la guerra me emocionó descubrir que había acertado, pues se divulgó que Glenn Seaborg y sus colaboradores de Berkeley habían conseguido crear una serie de elementos transuránicos —los elementos 93, 94, 95 Y 96—, descubriendo que formaban parte de una segunda serie de tierras raras (que, por analogía con la primera, los lantánidos, llamaron actínidos).[67]
Seaborg argumentó que el número de elementos de la segunda serie de tierras raras, en analogía con la primera, sería de catorce, y después del catorce (el elemento 103), uno podría esperar diez elementos de transición, y sólo entonces el elemento que concluía el período 7, que acabaría con un gas inerte como el elemento 118. A partir de aquí, sugirió Seaborg, comenzaría un nuevo período, que, como todos los demás, principiaría con un metal alcalino, el elemento 119.
Parecía que, de este modo, la tabla periódica podría extenderse a nuevos elementos más allá del uranio, elementos que podrían no existir ni siquiera en la naturaleza. No estaba claro que hubiera algún límite a esos elementos transuránicos: quizá los átomos de tales elementos serían demasiado grandes para mantenerse unidos. Pero el principio de la periodicidad era fundamental, y al parecer podía extenderse de manera indefinida.
Aunque Mendeléiev veía la tabla periódica primordialmente como una herramienta para organizar y predecir las propiedades de los elementos, también le parecía que encarnaba una ley fundamental, y en alguna ocasión especuló acerca del «mundo invisible de los átomos químicos». Pues la tabla periódica, eso estaba claro, apuntaba en dos direcciones: exteriormente hacia las propiedades manifiestas de los elementos, e interiormente hacia las propiedades atómicas aún desconocidas que determinaban aquéllas.
Durante aquel primer encuentro, extático y prolongado, en el Museo de la Ciencia, quedé convencido de que la tabla periódica no era algo ni arbitrario ni superficial, sino una representación de verdades que jamás serían desmentidas, sino que, por el contrario, se verían continuamente confirmadas, mostrando nuevas regiones con nuevos conocimientos, pues era algo tan profundo y simple como la propia naturaleza. Y el percibirlo produjo, en el muchacho de doce años que era yo entonces, una especie de éxtasis, la sensación (en palabras de Einstein) de que «se había alzado la esquina de un gran velo».