32 El átomo de Rutherford
La idea de que la materia está compuesta por una multitud de átomos minúsculos existe desde la época de los griegos. Pero mientras que los griegos pensaban que el átomo era el componente más pequeño e indivisible de la materia, los físicos del siglo XX se dieron cuenta de que esto no era así y comenzaron a investigar la estructura interna del átomo.
El modelo del pudín El primer nivel a abordar era el del electrón. Los electrones fueron liberados de los átomos en 1887 por Joseph John Thomson, quien disparó una corriente eléctrica a través de un gas contenido en un tubo de cristal. En 1904, Thomson propuso el «modelo del pudín» del átomo, donde los electrones cargados negativamente se espolvorean como pasas en una masa esponjosa de carga positiva. Hoy se habría llamado el modelo de la magdalena de chocolate. El átomo de Thomson era básicamente una nube de cargas positivas que contienen electrones, que se pueden liberar con relativa facilidad. Tanto los electrones como las cargas positivas se mezclan por el «pudín».
El núcleo Al cabo de poco tiempo, en 1909, Ernest Rutherford quedó desconcertado ante el resultado de un experimento que había realizado, en el cual las pesadas partículas alfa se disparaban a través de una delgada lámina de oro, tan fina que la mayoría de las partículas la atravesaban. Ante el asombro de Rutherford, una diminuta fracción de las partículas rebotaban hacia atrás en la lámina, dirigiéndose hacia él. Cambiaban de dirección 180 grados, como si hubieran chocado contra un muro de ladrillos. Se dio cuenta de que en el interior de los átomos de oro que componían la lámina había algo duro y macizo capaz de repeler las pesadas partículas alfa.
ERNEST RUTHERFORD (1871-1937)
El neozelandés Rutherford fue un alquimista contemporáneo, que transmutó un elemento, el nitrógeno, en otro, oxígeno, por medio de la radiactividad. Líder inspirador del Laboratorio Cavendish en Cambridge, Inglaterra, fue mentor de numerosos futuros ganadores del Premio Nobel. Recibió el apodo de «el cocodrilo» y este animal sigue siendo el símbolo del laboratorio en la actualidad. En 1910, sus investigaciones en la difusión de los rayos alfa y la naturaleza de la estructura interna del átomo le condujeron a identificar el núcleo.
Rutherford comprendió que el modelo del pudín de Thomson no podía explicar esto. Si un átomo era tan sólo un engrudo de partículas cargadas positiva y negativamente, ninguna sería lo bastante pesada para golpear de vuelta a la pesada partícula alfa. Por lo tanto, pensó que los átomos de oro debían tener un centro denso, llamado «núcleo» por el vocablo latino para la semilla de una nuez. Aquí nació un campo de la física nuclear: la física de los núcleos atómicos.
«Era tan increíble como si dispararas un cartucho de 15 pulgadas a un trozo de papel de seda y éste volviera hacia ti.»
Ernest Rutherford, 1964
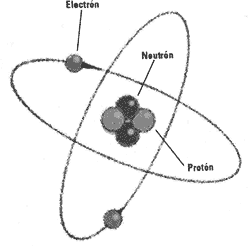
Isótopos Los físicos sabían cómo calcular la masa de diferentes elementos de la tabla periódica, de forma que conocían los pesos relativos de los átomos. Pero era más difícil ver cómo se ordenaban las cargas. Como Rutherford sólo conocía los electrones y los núcleos cargados positivamente, trató de equilibrar las cargas suponiendo que el núcleo estaba compuesto de una mezcla de protones (partículas cargadas positivamente que había descubierto en 1918 al aislar los núcleos de hidrógeno) y algunos electrones que neutralizaban parcialmente la carga. Los electrones restantes giraban alrededor del núcleo en los conocidos orbitales de la teoría cuántica. El hidrógeno, que es el elemento más ligero, tiene un núcleo que contiene sólo un protón con un electrón que orbita alrededor de él.
Un trío
Las sustancias radiactivas emiten tres tipos de radiación, llamadas alfa, beta y gamma. La radiación alfa consiste en pesados núcleos de helio que comprenden dos protones y dos neutrones unidos. Como son pesadas, las partículas alfa no llegan demasiado lejos antes de perder su energía en colisiones y se pueden detener con facilidad, incluso mediante un trozo de papel. El segundo tipo de radiación corresponde a las partículas beta; éstas son electrones de alta velocidad, muy ligeros y cargados negativamente. Las partículas beta llegan más lejos que la radiación alfa, pero se pueden detener por medio de un metal como una placa de aluminio. El tercer tipo son los rayos gamma, que son ondas electromagnéticas asociadas con fotones y que por tanto carecen de masa, pero poseen una gran cantidad de energía. Los rayos gamma son muy penetrantes y sólo pueden detenerse mediante bloques de hormigón o plomo. Los tres tipos de radiación son emitidos por átomos inestables que calificamos de radiactivos.
También se conocían algunas otras formas de elementos con pesos extraños, llamados isótopos. El carbono normalmente tiene un peso de 12 unidades atómicas, aunque en ocasiones se puede encontrar con un peso de 14 unidades. El carbono-14 es inestable con una vida media (el tiempo que tardan en desintegrarse la mitad de los átomos al emitir una partícula radiactiva) de 5.730 años, emitiendo una partícula beta para convertirse en nitrógeno-14. Esta reacción se utiliza para determinar la edad por medio de radiocarbono de los materiales arqueológicos de miles de años de antigüedad, como la madera o el carbón de las hogueras.
Neutrones A principios de los años treinta, se descubrió un nuevo tipo de «radiación», que era lo bastante pesada para liberar protones de la parafina, pero sin carga. El físico de Cambridge James Chadwick demostró que esta nueva radiación era en realidad una partícula neutra con la misma masa que el protón. Se bautizó con el nombre de neutrón y el modelo atómico fue reorganizado. Los científicos se dieron cuenta de que un átomo de carbono-12, por ejemplo, contiene 6 protones y 6 neutrones en el núcleo (lo que le confiere una masa de 12 unidades atómicas) y 6 electrones que giran alrededor. Los neutrones y protones se conocen como núcleo.
«Nada existe salvo los átomos y el espacio vacío; todo lo demás es una opinión.»
Demócrito, 460-370 a. C.
Fuerza fuerte El núcleo es muy pequeño, comparado con el tamaño total del átomo y sus electrones orbitando alrededor. Cientos de miles de veces más pequeño que el átomo, el núcleo ocupa tan sólo unos pocos femtómetros (10-15 metros). Si el átomo fuera proporcional al diámetro de la Tierra, el núcleo central sería sólo de 10 kilómetros de ancho, la longitud de Manhattan. El núcleo alberga prácticamente toda la masa del átomo en un punto diminuto y esto incluye muchas decenas de protones. ¿Qué mantiene unidas todas las cargas positivas en un espacio tan pequeño y con tanta fuerza? Para vencer la repulsión electrostática de las cargas positivas y mantener el núcleo unido, los físicos tuvieron que inventar un nuevo tipo de fuerza, llamada fuerza nuclear fuerte.
Si los dos protones se acercan mucho, inicialmente se repelen a causa de sus cargas similares (siguiendo la ley de la inversa del cuadrado de Maxwell). Pero si se acercan todavía más, la fuerza nuclear fuerte los bloquea juntos. La fuerza fuerte sólo aparece en separaciones muy pequeñas, pero es mucho mayor que la fuerza electroestática. Si los protones son atraídos aún más cerca el uno del otro, se resisten, actuando como esferas macizas; por tanto, hay un límite estricto a lo próximos que pueden llegar a estar. Este comportamiento significa que el núcleo está fuertemente unido, muy compacto y duro como una roca.
En 1934, Hideki Yukawa propuso que la fuerza nuclear era transportada por partículas especiales (llamadas mesones) que actúan de forma similar a los fotones. Protones y neutrones están adheridos por los mesones, que se intercambian. Incluso en la actualidad sigue siendo un misterio la razón por la que la fuerza nuclear fuerte actúa a una escala de distancias tan precisa: por qué es tan débil fuera del núcleo y tan fuerte a corta distancia. Es como si bloqueara a los nucleones a una distancia precisa. La fuerza nuclear fuerte es una de las cuatro fuerzas fundamentales, junto con la gravedad, el electromagnetismo y otra fuerza nuclear llamada fuerza débil.
Cronología:
1887 d. C.: Thomson descubre el electrón.
1904 d. C.: Thomson propone el modelo de pudín.
1909 d. C.: Rutherford realiza su experimento de la lámina de oro.
1911 d. C.: Rutherford propone el modelo nuclear.
1918 d. C.: Rutherford aísla el protón.
1932 d. C.: Chadwick descubre el neutrón.
1934 d. C.: Yukawa propone la fuerza nuclear fuerte.
La idea en síntesis: el núcleo macizo