08 Ley de los gases ideales
Si alguna vez ha utilizado una olla a presión entonces ha utilizado la ley de los gases ideales para cocinar su comida. ¿Cómo funcionan las ollas a presión? Son recipientes herméticos que evitan la pérdida de vapor durante la cocción. Como no hay pérdida de vapor, cuando el líquido hierve el vapor adicional se acumula y eleva la presión del interior. La presión puede llegar a ser tan elevada que evita que se acumule más vapor de agua y provoca que la temperatura del caldo del interior sobrepase el punto de ebullición normal del agua, 100 grados Celsius. De esta manera la comida se cocina con mayor rapidez y no pierde sabor.
La ley de los gases ideales se formula del siguiente modo: PV=nRT, donde P es la presión, V es el volumen, T es la temperatura y n es el número de moles del gas (donde 1 mol tiene 6x1023 átomos en él, lo que se denomina número de Avogadro) y R es un número llamado la constante del gas.
La ley de los gases ideales fue formulada por vez primera por el físico francés Émile Clapeyron en el siglo XIX, el cual explicó la relación entre presión, temperatura y volumen. La presión aumenta si el volumen se comprime o si la temperatura se eleva. Imaginemos una caja llena de aire. Si reducimos el volumen de la caja a la mitad, la presión del interior se doblará. Si calentamos la caja original al doble de su temperatura, la presión también se doblará.
«Hay un simbolismo esperanzador en el hecho de que las banderas no ondeen en el espacio.»
Arthur C. Clarke, n. 1917
Al desarrollar la ley de los gases ideales, Clapeyron combinó dos leyes previas, una de Robert Boyle y otra de Jacques Charles y Joseph Louis Gay-Lussac. Boyle había descubierto ciertos vínculos entre presión y volumen y temperatura. Clapeyron unió las tres magnitudes y denominó «mol» a una cantidad de gas determinada, un término con el que describía un cierto número de átomos o moléculas, a saber 6x1023 (es decir, un 6 seguido de 23 ceros), también conocido como número de Avogadro. Aunque esto parezca una enorme cantidad de átomos, es aproximadamente el número de átomos que hay en la mina de un lápiz. El mol se define como el número de átomos de carbono -12 que se encuentran en 12 gramos de carbono. De otro modo, si obtuviéramos el número de Avogadro de las uvas, éstas tomarían el volumen total de la Tierra.
Gas ideal Entonces, ¿qué es un gas ideal? Por decirlo de un modo sencillo, un gas ideal es el que obedece a la ley de los gases ideales. Y esto es así porque los átomos o moléculas que lo componen son muy pequeños en comparación con la distancia que los separa, así que cuando rebotan alrededor se dispersan unos a otros claramente. Además, no hay fuerzas adicionales entre partículas que puedan provocar uniones, como sucede con las cargas eléctricas.
Los gases «nobles» como el neón, el argón y el xenón se comportan como gases ideales formados por átomos individuales (más que moléculas). Las moléculas ligeras simétricas como las del hidrógeno, el nitrógeno o el oxígeno se comportan prácticamente como gases ideales, mientras que las moléculas de gas más pesadas, como las del butano, es menos probable que lo hagan.
Los gases tienen una densidad muy baja y los átomos o moléculas que hay en ellos no se mantienen unidos, sino que pueden moverse libremente. En los gases ideales, los átomos se comportan como miles de bolas de goma sueltas por una pista de squash, rebotando unas contra otras y contra las paredes del recinto. Los gases carecen de límites, pero se pueden mantener en el interior de un recipiente que defina un determinado volumen. Una reducción en el tamaño de ese recipiente comprime las moléculas y, de acuerdo con la ley de los gases, aumenta tanto la presión como la temperatura.
La presión de un gas ideal se produce por la fuerza de los átomos y las moléculas que chocan contra las paredes del recipiente y también entre sí, cuando se mueven de un lado a otro. De acuerdo con la tercera ley de Newton, las partículas que rebotan ejercen una fuerza opuesta sobre las paredes del recipiente. Las colisiones con las paredes son elásticas, así que las partículas rebotan sin perder energía, ni quedarse adheridas, sino que transfieren el momento a la caja, el cual es percibido como una presión. El momento haría que la caja se moviera hacia afuera, pero su fuerza resiste cualquier movimiento, y las fuerzas se perciben en numerosas direcciones, compensándose por término medio.
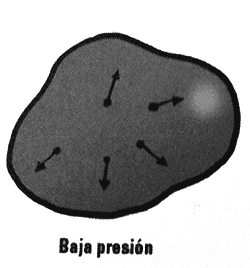
Elevar la temperatura incrementa la velocidad de las partículas, así que la fuerza ejercida sobre las paredes es aún mayor. La energía calorífica se transfiere a las moléculas, provocando un aumento en su energía cinética y haciendo que se muevan más rápido. Cuando chocan contra las paredes transfieren un momento aún mayor, incrementando la presión.
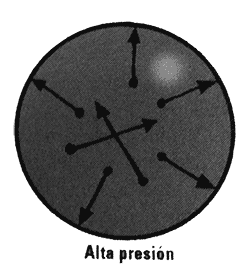
Reducir el volumen incrementa la densidad del gas, por lo que se producirán más colisiones contra las paredes y la presión volverá a elevarse. La temperatura también se eleva porque, como la energía se conserva, las moléculas aumentan de velocidad cuando se encuentran en un espacio limitado.
Algunos gases reales no siguen exactamente esta ley. Los gases con moléculas más grandes o más complejas pueden experimentar fuerzas adicionales entre ellas, lo que significa que tienden a agruparse con mayor frecuencia que un gas ideal. Estas fuerzas de adhesión se originan debido a las cargas eléctricas de los átomos que componen las moléculas y es más probable que existan si el gas está muy comprimido o muy frío de forma que las moléculas se mueven con lentitud. Las moléculas verdaderamente adhesivas como las proteínas o las grasas nunca se convierten en gases.
Presión y altitud Cuando escalamos una montaña en la Tierra la presión atmosférica desciende, comparado con la presión que existe a nivel del mar, sólo porque tenemos menos atmósfera encima. Seguramente habrá observado que esto coincide con una bajada brusca de la temperatura. Cuando volamos en avión, la temperatura exterior desciende hasta alcanzar temperaturas bajo cero. Esto es una demostración de la ley de los gases ideales.
A gran altitud, como la presión atmosférica es baja, el agua hierve a una temperatura mucho más baja que a nivel del mar. Como las comidas no se cuecen bien, los montañeros a veces utilizan ollas a presión. Incluso Charles Darwin se lamentaba de no tener una a mano durante sus viajes por los Andes en 1835, ya que conocía la «olla a vapor» que había sido inventada por el físico francés Denis Papin a finales del siglo XVII.
Como escribió Darwin en su Viaje en el Beagle:
En el lugar donde dormimos, el agua hervía necesariamente a una menor temperatura debido a la disminución de presión atmosférica, a una temperatura más baja que en un país menos elevado; era el caso contrario al de la olla de Papin. Así, las patatas, después de estar varias horas cociéndose en agua estaban casi tan duras como al principio. Dejamos incluso el cazo al fuego toda la noche y al hervirlas de nuevo a la mañana siguiente seguían sin cocerse. Recordé esto mientras oía a mis compañeros discutir acerca de la causa de aquello; habían llegado a la sencilla conclusión de que «aquella maldita olla [que era nueva] no servía para cocer patatas».
Vacío Si pudiéramos volar sobre las montañas hasta la cima de la atmósfera, quizá hasta el espacio exterior, la presión descendería casi hasta cero. Un vacío perfecto no contendría ningún átomo, pero esto es imposible en el universo. Incluso en el espacio exterior, hay átomos diseminados, aunque sean tan sólo unos pocos átomos de hidrógeno por centímetro cúbico. Los filósofos griegos Platón y Aristóteles no creían que pudiera existir el vacío puro, como tampoco podía existir la «nada».
Actualmente las ideas de la mecánica cuántica también han dejado a un lado la idea del vacío como espacio vacío, sugiriendo que está repleto de partículas subatómicas virtuales que aparecen y desaparecen repentinamente. La cosmología ha llegado a sugerir incluso que el espacio puede tener una presión negativa que se manifiesta como energía oscura, acelerando la expansión del universo. Parece que la naturaleza aborrece verdaderamente el vacío.
Cronología:
aprox. 350 a. C.: Aristóteles afirma que «la naturaleza aborrece el vacío».
1650 d. C.: Otto von Guericke construye la primera bomba de vacío.
1662 d. C.: Se formula la ley de Boyle (PV=constante).
1672 d. C.: Papin inventa su olla.
1802 d. C.: Se formula la ley de Charles y Gay Lussac (V/T=contante).
1834 d. C.: Clapeyron deduce la ley de los gases ideales.
La idea en síntesis: la física de las ollas a presión