Kapitel 9
Wir verwechseln DNS mit Krankheit
Wie Gentests Ihnen fast jede Krankheit anhängen
Ich schätze die Genetik wirklich. In der Highschool machte es mir Spaß, die Wahrscheinlichkeit verschiedener Genotypen zu berechnen. Dabei stützte ich mich auf die einfachen Regeln, die Gregor Mendel entdeckte, als er Erbsen anbaute. Auf dem College faszinierte mich die Entdeckung, dass der Selektionsdruck, den eine einzige sehr häufige Infektionskrankheit (Malaria) ausübt, das Fortbestehen bestimmter Infektionskrankheiten (Sichelzellenanämie, Favismus durch Mangel an Glucose-6-Phosphat-Dehydrogenase) beim Menschen sogar begünstigt. Und an der Universität war ich gefesselt von den Vorgängen um die DNS: wie die Doppelhelix reproduziert wird; wie DNS zu RNS transkribiert wird, sodass Proteine entstehen; wie DNS rekombiniert wird, sodass wir einen Teil der DNS unserer Mutter und unseres Vaters an unsere Kinder weitergeben; und wie andere Lebensformen (Viren) sie ausbeuten, um unsere Zellen für sich arbeiten zu lassen.1 Genetik ist eine wundervolle Mixtur aus Mathematik, Evolutionsbiologie und Biochemie. Sie ist wirklich interessant.
Viel weniger begeistert bin ich davon, die Gene gesunder Menschen zu testen. Manche Leute glauben, Gentests seien der Weg zu optimaler Gesundheit. Sie helfen uns bereits heute, maßgeschneiderte Therapien für Individuen zu entwickeln, und wahrscheinlich werden sie eines Tages noch besser vorhersagen, wie Patienten auf verschiedene Medikamente ansprechen. Die Gentherapie – Eingriffe in die DNS zur Behandlung von Krankheiten – könnte sich unter bestimmten Umständen als echtes medizinisches Heilverfahren herausstellen. Aber es ist durchaus möglich, dass Gentests der Gesundheit vieler Menschen schaden.
Zahlreiche Firmen entnehmen Ihnen heute schon Ihre DNS (und Ihr Geld) und sagen Ihnen die Zukunft voraus. Eine dieser Firmen, 23andMe, verspricht, »die Geheimnisse Ihrer DNS aufzudecken«, während Navigenics Sie auffordert, sich testen zu lassen und »alles zu tun, was Sie können, um gesund zu bleiben«. Und deCODEme hofft, dass Gentests »die Menschen veranlassen, das Richtige zu tun«. Diese kommerzialisierten Gentests dienen scheinbar der Gesundheit; aber meiner Meinung nach führen sie zu Überdiagnosen. Die Diagnose, um die es hier geht, gilt nicht einer Krankheit, sondern einer genetischen Disposition (Veranlagung) für eine Krankheit. Kurz gesagt, Gentests suchen nach genetischen Risikofaktoren. Da jeder Mensch mit irgendwelchen Risiken leben muss, macht diese Strategie buchstäblich jeden krank.
Wir haben bereits Gentests, die nach Dispositionen für zahlreiche Krankheiten suchen – mehr, als ich hier besprechen kann. Und da wir uns mitten in einer Explosion der Genforschung befinden, wird es zweifellos noch mehr Tests geben, wenn Sie dieses Buch lesen. Aber die grundlegenden Fragen, die Gentests aufwerfen, werden sich nicht ändern; es sind die gleichen, die wir immer stellen sollten, wenn es um Früherkennung geht: Wie viele Menschen werden unnötigerweise erfahren, sie seien irgendwie anormal? Und was werden wir ihnen antun?
Die Vision: Eine Bestandsaufnahme des Genoms
Stellen Sie sich vor, dass eines Tages jeder junge Erwachsene sein Genom (Erbgut) untersuchen lässt, um herauszufinden, ob er eine Veranlagung für Herzkrankheiten, psychische Störungen, Diabetes oder Krebs hat. Nehmen wir nun an, Sie sind eine gesunde zwanzigjährige Frau, die sich ihrem ersten Genom-Scan unterzieht. Sie spucken in einen speziellen Becher – ja, auch Ihr Speichel enthält Ihre Gene – und schicken ihn an eine von mehreren Firmen, die Gene untersuchen. Ein paar Wochen später erhalten Sie eine E-Mail, die Ihnen mitteilt, dass Ihr persönliches Risikoprofil vorliegt. Sie öffnen den Bericht.
Bestandsaufnahme des Genoms von: Ms. Smith
|
Krankheit |
Ihr Genom-Scan |
Lebenszeitrisiko* |
Ihr Risiko im Vergleich mit dem Durchschnitt |
|
Ovarialkrebs |
OvXX vorh. |
8,5 % |
4 Mal höher |
|
Lungenkrebs |
LNx5 fehlt |
0,5 % |
etwa halb so hoch |
|
Brustkrebs |
Bc59y vorh. |
17 % |
etwa 1,5 Mal höher** |
|
Herzkrankheiten |
CHDmd21 vorh. |
40 % |
1,25 Mal höher |
|
Makuladegeneration |
CHDmd21 vorh. RetinX76 fehlt |
Netto-Effekt unbekannt |
unterdurchschnittlich |
* So hoch ist das Risiko, dass Sie diese Krankheit im Laufe Ihres Lebens bekommen.
** Die Genauigkeit dieser Schätzung ist in der medizinischen Literatur stark umstritten.
Aus diesem Risikoprofil ergibt sich, dass Sie mit einer Wahrscheinlichkeit von 8,5 Prozent irgendwann im Leben Eierstockkrebs bekommen. Ihr Risiko ist also vier Mal höher als das durchschnittliche Risiko. Zum Glück besitzen Sie nicht das Gen, das sowohl bei Rauchern als auch bei Nichtrauchern stark mit einem erhöhten Lungenkrebsrisiko zusammenhängt. Wir wissen daher, dass Ihr Risiko für diese Krankheit deutlich unter dem Durchschnitt liegt. Sie haben jedoch das Gen, das nach Ansicht einiger Forscher Ihr Brustkrebsrisiko um fast 50 Prozent erhöht. Allerdings erwähnt der Bericht, dass diese Schätzung in der medizinischen Literatur neuerdings stark umstritten ist.
Das Profil zeigt, dass Ihr Risiko für Herzkrankheiten um 1,25 Prozent über dem Durchschnitt liegt. Ihnen fällt ein, dass Herzkrankheiten in den Vereinigten Staaten bei Weitem die häufigste Todesursache sind; daher müssen Sie diese Zahlen ernst nehmen. (Sie sind von diesem Befund nicht überrascht, weil Ihre Mutter vor ein paar Jahren einen Herzanfall hatte und Sie wissen, dass Krankheiten in der Familie oft ein guter Indikator für Ihr Risiko sind.) Eines der Gene, das Ihr Risiko für Herzkrankheiten erhöht, senkt zugleich Ihr Risiko für eine Makuladegeneration, die zu einem allmählichen Verlust des Sehvermögens führen würde. Andererseits besitzen Sie auch ein Gen, das Ihr Risiko für eine Makuladegeneration erhöht. Man erklärt Ihnen, dass Wissenschaftler intensiv daran arbeiten, dieses Verhältnis genauer zu quantifizieren, dass derzeit jedoch keine präziseren Angaben möglich seien.
Ein seltsames Risikoprofil. Es zeigt Ihnen nicht, wie Sie optimale Gesundheit erlangen. Es sagt Ihnen nicht einmal, was Sie tun können, um mit größerer Wahrscheinlichkeit gesund zu bleiben. Und es warnt Sie nicht vor Gefahren, die möglicherweise auf Sie zukommen: mehr Tests, mehr Überdiagnosen und mehr medizinische Maßnahmen. Das Ganze mag sich wie Science-Fiction anhören, aber es ist keine. Die meisten dieser Tests sind heute schon erhältlich, und der Rest könnte bald verfügbar sein, wenn man bedenkt, wie schnell die Genetik sich entwickelt. Die Vision einer Bestandsaufnahme des Genoms hat vor über einem Jahrzehnt Francis Collins, der Leiter des Human Genome Project, als Erster beschrieben. In seinem Jahresbericht an den Kongress schrieb Collins 1998: »Eine Bestandsaufnahme des Genoms könnte Patienten und Ärzten nützliche Informationen über das Krankheitsrisiko eines Individuums liefern und ihnen zeigen, welche vorbeugenden Maßnahmen – soweit verfügbar – zu ergreifen sind.«2 Es ist zwar verführerisch zu glauben, mehr Informationen über Ihre Veranlagung für bestimmte Krankheiten könnten nur hilfreich sein; aber mit solchen Informationen sind echte Risiken verbunden.
Ich erinnere mich daran, dass ich eine ähnliche Bemerkung machte, als ich mit dem Vater einer meiner Jungendfreunde über das Human Genome Project diskutierte. Ich respektierte diesen Mann sehr. Er war Syndikus eines großen städtischen Flughafens und hatte immer Freude an hitzigen politischen Diskussionen. Er äußerte den Verdacht, ich sei »wissenschaftsfeindlich« und würde mich deshalb gegen mehr Informationen wehren. Das tat weh. Mir war, als werfe er mir vor, ein religiöser Fundamentalist zu sein, Kopernikus zu widersprechen und die Erde für den Mittelpunkt des Universums zu halten – oder im Rechtsstreit zwischen dem Bundesstaat Tennessee und John Thomas Scopes im Jahr 1925 (bekannt als der Affenprozess) die Evolutionstheorie abgelehnt zu haben. Aber das Gespräch bewirkte, dass ich über einen wichtigen Unterschied nachdachte: über den Unterschied zwischen mehr Wissen über Humangenetik und mehr Wissen über das individuelle Genom. Das sind zwei verschiedene Themen. Ich befürworte den wissenschaftlichen Forschritt, mache mir aber große Sorgen über die unerwünschten Nebenwirkungen individueller Gentests. Wir verstehen weniger, als wir glauben. Um zu verstehen, warum es gefährlich sein kann, mehr über Ihre persönlichen Risiken zu erfahren, müssen Sie eine Vorstellung davon haben, was die Medizin mit diesen Informationen anfängt.
Mehr Tests, mehr Behandlungen
Eine Diagnose, die darauf schließen lässt, dass Ihr Risiko für bestimmte Krankheiten hoch ist, hat erste Folgen. Sie bewirkt, dass alle (Sie, Ihre Familie, Ihre Ärzte und vielleicht sogar Ihre Versicherung) sich Sorgen darüber machen, was demnächst auf Sie zukommt. Diese Angst führt meist zu weiteren Untersuchungen, die häufig weitere absehbare »Krankheiten« ausfindig machen, begleitet von einigen Überraschungsfunden. Die Folge sind weitere Maßnahmen: auf jeden Fall Medikamente, vielleicht auch eine Operation.
Eine Frau mit dem Brustkrebsgen beginnt möglicherweise früher als üblich mit der Mammografie (zum Beispiel mit fünfunddreißig statt mit fünfzig Jahren) und wird häufiger geröntgt. Frühere und häufigere Mammografien können nicht nur zu Überdiagnosen führen, sondern setzen Frauen, die ohnehin eine Veranlagung für Brustkrebs haben, einer höheren Strahlenbelastung aus. Ein Mann mit dem Prostatakrebsgen beginnt vielleicht früher mit PSA-Tests (zum Beispiel mit vierzig statt mit fünfzig Jahren) und lässt sich öfter testen. Da die genetische Information in beiden Fällen auf ein hohes Risiko hinweist, werden die Ärzte weniger zurückhaltend sein, was Biopsien anbelangt. Und wie Sie inzwischen wissen, führen diese häufigeren Untersuchungen unweigerlich zu mehr Diagnosen, mehr Überdiagnosen und mehr Behandlungen wegen Brust- oder Prostatakrebs. Und wenn auf einem Schichtbild Körperteile zu sehen sind, die gar nicht untersucht werden sollen (was bei CT-Scans) vorkommt, sind unerwartete Befunde möglich, die ebenfalls weitere Behandlungen nach sich ziehen.
Allein die Feststellung, dass Ihr Risiko erhöht ist, kann Maßnahmen auslösen, die vor Krankheit schützen sollen. Eine Frau, die erfährt, dass ihr Brustkrebsrisiko erhöht ist, nimmt vielleicht Tamoxifen, um das Risiko zu senken, oder sie lässt sich sogar vorbeugend die Brüste entfernen. Ein Mann, dem der Arzt mitteilt, sein Prostatakrebsrisiko sei erhöht, nimmt möglicherweise Finasterid oder lässt sich vorsichtshalber die Prostata entfernen. Das Hauptproblem beim Gentest ist die Ungewissheit; denn niemand weiß, wer erkrankt und was man jetzt dagegen tun sollte. Ein großer Teil dieser Ungewissheit wird uns immer begleiten, einerlei, wie gut wir die Humanbiologie verstehen.
Genetik ist nicht Schicksal
Die in den Genen enthaltenen Informationen werden oft als Bauplan des Körpers bezeichnet, obwohl einige Wissenschaftler der Meinung sind, ein Rezept, das jedes Mal ein wenig anders ausfällt, sei die bessere Analogie. Es gibt ein Gen, das die Augenfarbe bestimmt, ein Gen, das die Insulinproduktion steuert, und ein Gen, das Sie in die Lage versetzt, die Zunge einzurollen (oder auch nicht). Und Sie haben ungefähr 25 000 weitere Gene. Gene sind aus nur vier Bausteinen zusammengesetzt, deren Namen mit den Buchstaben A, C, G und T abgekürzt werden. Der Code entsteht durch die Kombination dieser Bausteine. Ein durchschnittliches Gen hat 3000 Bausteine (die Bandbreite reicht von 252 bis 2,4 Millionen). Die große Mehrzahl – über 99 Prozent – dieser genetischen Informationen ist bei allen Menschen identisch. Das ergibt Sinn, weil wir alle sehr viel gemeinsam haben: zwei Augen, ein Herz mit vier Kammern, den aufrechten Gang und so weiter. Aber auch die wenigen genetischen Informationen, die sich von Mensch zu Mensch unterscheiden, sind wichtig; denn sie tragen sehr dazu bei, dass jeder Mensch ein Individuum ist.
Im einfachsten Fall würden die Gene alles bestimmen, sämtliche individuellen Merkmale eines Menschen. Aber genetische Vielfalt ist nicht alles. Selbst eineiige Zwillinge, die genau die gleiche DNS (den gleichen Genotyp) haben, sind nicht exakt gleich. Umwelteinflüsse, vor allem in jungen Jahren, spielen ebenfalls eine Rolle. Faktoren wie Ernährung, Toxine und Strahlung beeinflussen die individuellen Merkmale schon vor der Geburt, ebenso körperliche und intellektuelle Aktivitäten in der Kindheit. In der Wissenschaft besteht weitgehend Einigkeit darüber, dass fast alle Unterschiede die Folge der Interaktion zwischen Genen und Umweltfaktoren sind. Auch das Glück oder der Zufall mischen mit. Die gleichen Genotypen in derselben Umwelt können ziemlich unterschiedliche Menschen hervorbringen.
Das führt uns zu einer wichtigen Unterscheidung, die auch für Gentests bedeutsam ist: zum Unterschied zwischen Genotyp und Phänotyp. Der Mensch, den andere sehen – Ihre körperlichen und biochemischen Eigenheiten sowie Ihr Verhalten –, ist der Phänotyp. Sie nehmen nicht Ihren Genotyp wahr, sondern Ihren Phänotyp. Die Kombination aus Genotyp, Umwelt und Zufall bestimmt Ihren Phänotyp.
Gentests versuchen, Ihren Phänotyp allein anhand Ihres Genotyps vorherzusagen. Nun besteht zwar kein Anlass dafür, mit einem Gentest einen Aspekt Ihres Phänotyps vorherzusagen, den Sie bereits kennen – Sie brauchen zum Beispiel keinen Gentest, um herauszufinden, ob Sie blaue Augen haben –, aber einige Gentestanbieter werben dennoch für Tests dieser Art. Sie behaupten, sie könnten mithilfe eines Gentests feststellen, ob Sie Milchprodukte vertragen, Rosenkohl mögen oder Probleme mit dem Ohrenschmalz haben.
Es gibt tatsächlich ein Gen, das etwas damit zu tun hat, ob Rosenkohl Ihnen schmeckt. Vielleicht haben Sie dieses Gen, vielleicht nicht. Nun ist zwar Ihr Genotyp ein wichtiger Faktor bei der Entwicklung Ihres Phänotyps, aber er ist nicht der einzige. Vielleicht haben Ihre Eltern Ihnen beigebracht, Rosenkohl zu verabscheuen. Oder Sie haben Ihre Erfahrungen mit diesem Gemüse nur in der Schulkantine und nur mit warmen Speisen gesammelt. Vielleicht haben Sie nie gut zubereiteten Rosenkohl probiert – frisch geerntet, leicht gedünstet und dann mit Knoblauch, Senf und Walnüssen kurz angebraten (aus irgendeinem Grund habe ich in meinen ersten drei Lebensjahrzehnten keinen Rosenkohl gegessen … entschuldige, Mama). Aber wenn Sie Rosenkohl nicht mögen, kümmert es Sie dann wirklich, ob die Umwelt oder die Gene daran schuld sind? Und wenn Rosenkohl Ihnen schmeckt, würden Sie aufhören, ihn zu essen, wenn Sie erführen, dass Ihnen das Rosenkohl-Gen fehlt? Genetiker sind die Ersten, die darauf hinweisen, dass der Phänotyp den Genotyp übertrumpft.3
Wer abnorme Gene hat, muss nicht krank sein
Der einzige zwingende Grund, den Genotyp eines gesunden Menschen zu bestimmen, ist die Vorhersage des Phänotyps. Es geht also um die Frage, ob ihm bestimmte Krankheiten drohen und ob er diese an seine Kinder vererben kann. Aber was für individuelle Merkmale gilt, das gilt auch für Krankheiten. Manche Krankheiten entwickeln sich nur dann, wenn bestimmte Gene vorhanden sind oder fehlen; aber die meisten Krankheiten spiegeln die Wechselwirkung zwischen Genom, Umwelt und reinem Zufall wider. Die Öffentlichkeit (ganz zu schweigen von den Ärzten) kann leicht in eine Falle tappen und eine genetische Anomalie mit einer Krankheit gleichsetzen. Manche Genotypen sagen tatsächlich fast unfehlbar voraus, bei welchen Individuen sich bestimmte Phänotypen ausbilden werden; andere sind bestenfalls schlechte Indikatoren. Die prozentuale Wahrscheinlichkeit, mit der ein bestimmter Genotyp den Phänotyp ausbildet, heißt Penetranz. Die Penetranz gibt also an, wie oft ein bestimmtes Gen in einer Gruppe von Individuen seine Wirkung entfaltet.
Nur bei wenigen genetischen Anomalien beträgt die Penetranz fast 100 Prozent. Ein klassisches Beispiel ist die Mukoviszidose, eine Krankheit, die in der Kindheit ausbricht und die Sekretion in den Lungen, in der Leber, im Pankreas und im Darm stört. Die meisten Menschen mit dieser Krankheit werden nicht älter als vierzig. Die Mukoviszidose ist eine autosomal-rezessive Erbkrankheit: Wenn Sie von einem Elternteil das abnorme Gen und vom anderen ein normales Gen geerbt haben, sind Sie zwar Träger, werden aber nicht krank. Wenn Sie jedoch das Pech haben, von beiden Elternteilen das abnorme Gen geerbt zu haben, ist es fast sicher, dass die Krankheit sich bei Ihnen entwickelt.4
Ein anderes Beispiel für eine eindeutig genetische Anomalie ist die Huntington-Krankheit, eine degenerative neurologische Krankheit, die in der Lebensmitte ausbricht und zuckende, unwillkürliche Bewegungen auslöst, aber auch die geistigen Fähigkeiten beeinträchtigt. Eine Therapie gibt es nicht. Die Huntington-Krankheit ist eine autosomal-dominante Erbkrankheit; das heißt, Sie brauchen das abnorme Gen nur von einem Elternteil zu erben, damit die Krankheit sich entwickelt. In der mendelschen Genetik ist auch diese Krankheit ein Klassiker, nämlich eine autosomal-dominante Krankheit mit fast 100 Prozent Penetranz.
Die Penetranz der meisten Erbkrankheiten liegt jedoch deutlich unter 100 Prozent. Selbst die gefährlichen, mit Brustkrebs zusammenhängenden Gene BRCA1 und BRCA2 sagen ein Brustkrebsrisiko voraus, kein unabwendbares Schicksal. Penetranzschätzungen reichen von 30 bis 70 Prozent.5 Das ist die Wahrscheinlichkeit, im Alter von siebzig Jahren an Brustkrebs zu erkranken, nicht das Sterberisiko. Da diese Schätzungen eher für Frauen gelten, die sowohl die abnormen Gene besitzen als auch familiär stark vorbelastet sind, könnte die Penetranz der Gene bei Frauen ohne familiäre Belastung geringer sein. Wer die beiden Gene nicht besitzt, ist vor Brustkrebs nicht geschützt; das Risiko ist ungefähr durchschnittlich hoch – das heißt, die Wahrscheinlichkeit, im Alter von siebzig Jahren zu erkranken, beträgt rund 10 Prozent –, weil die weitaus meisten Brustkarzinome (über 95 Prozent) nichts mit den BRCA-Genen zu tun haben.6 Sie kommen vielmehr sporadisch vor und spiegeln die Wechselwirkungen zwischen anderen Risikofaktoren und die Rolle des Zufalls wider.7
Viele abnorme Gene haben sogar eine niedrigere Penetranz. Das Spektrum reicht von vollständiger Penetranz über hohe Penetranz bis zu niedriger Penetranz. Und je mehr wir über das Genom lernen, desto klarer wird uns, dass vollständige und hohe Penetranz relativ selten vorkommen und dass die meisten genetischen Informationen wenig mit der Entwicklung einer Krankheit zu tun haben.
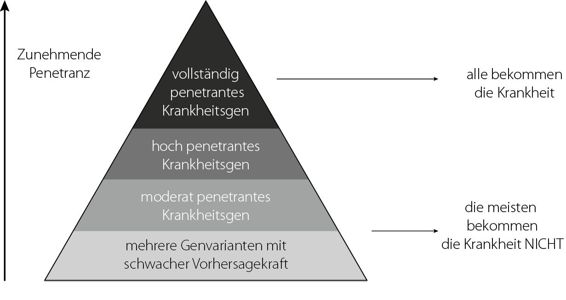
Abbildung 9.1 Das Spektrum der Penetranz von Krankheitsgenen
Dieses Penetranzspektrum beginnt die Sprache der Genetiker zu beeinflussen. Manche sind der Meinung, der Begriff Genmutation bedeute Gewissheit und solle daher für hoch penetrante Gene vorbehalten bleiben. Für Gene mit niedrigerer Penetranz bevorzugen die Genetiker die Begriffe Genvariante und genetische Aberration (Abweichung).8 Die Basis des Spektrums bilden Genvarianten, die so schwach penetrant sind, dass wir die Testergebnisse für mehrere Varianten (an verschiedenen Punkten des Genoms) kombinieren müssen, um zuverlässige Vorhersagen über den Phänotyp machen zu können.
Wir lernen zwar jeden Tag mehr über das Genom, aber die meisten neuen Informationen betreffen schwach penetrante genetische Varianten. Der Grund dafür ist einfach: Vollständig penetrante Krankheitsgene sind seit Jahrzehnten bekannt. Wir mussten nicht die DNS lesen, um die Erbanlagen der Mukoviszidose und der Huntington-Krankheit zu verstehen. Dass es sich hierbei um Erbkrankheiten handelt, wurde schon in den 1930er-Jahren und in den 1870er-Jahren gefolgert.9 Vollständig penetrante Krankheitsgene sind die tief hängenden Früchte der Genetik, weil sie lediglich ein Studium des Stammbaums erfordern. Wenn Ihr Vater, der Vater Ihres Vaters, zwei von drei Brüdern und die Hälfte Ihrer Vettern eine seltene Krankheit haben, ist ziemlich offensichtlich, dass es sich um eine Erbkrankheit handelt. Das meiste, was wir heutzutage entdecken, ist viel weniger offenkundig, weil sich am Stammbaum nicht ablesen lässt, ob Erbkrankheiten vorliegen. Um das herauszufinden, brauchen wir sorgfältig geplante Studien, an denen Hunderte oder gar Tausende von Menschen teilnehmen.
Überdiagnosen und Penetranz sind umgekehrt aufeinander bezogen. Je weniger penetrant ein Gen ist, desto mehr Überdiagnosen gibt es, weil die meisten Menschen mit niedrig penetranten Genen die Krankheit nicht bekommen.
Fallstudie: Eine Erbkrankheit stört den Eisenstoffwechsel
Erbliche Hämochromatose ist eine genetisch bedingte Krankheit, die dazu führt, dass zu viel Eisen aus dem Essen resorbiert wird. Das überschüssige Eisen sammelt sich im ganzen Körper an, im Herzen, in der Leber, im Pankreas, in den Nebennieren sowie im Stütz- und Bewegungsapparat. Dies ist eine der Krankheiten, mit denen wir uns als Medizinstudenten nicht gerne befassten, weil sie zu viele Erscheinungsformen hat. Die Patienten klagen über Herzversagen, Leberzirrhose, Diabetes, Nebennierenschwäche, Arthritis oder ein allgemeines Krankheitsgefühl. Zudem gibt es viele andere Krankheiten mit ähnlichen Symptomen. Wir hatten den Eindruck, dass alles an der Hämochromatose komplex und vage ist. Da sie derart viele Symptome hervorrufen kann, tauchte sie fast immer auf einer Liste möglicher Diagnosen auf. Solche Krankheiten wecken in jungen Ärzten den Wunsch, die komplexe innere Medizin zu meiden und sich auf Kardiologie oder Chirurgie zu spezialisieren, wo die Probleme unkomplizierter sind.
Aber wenigstens die Behandlung ist ziemlich unkompliziert. Wenn man das Eisen im Körper loswerden will, muss man dem Patienten nur Blut entnehmen. Ja, es stimmt: Die Standardtherapie bei Hämochromatose war und ist der Aderlass, eine Methode, die in der Medizin eine düstere Vergangenheit hat. Mehr als tausend Jahre lang entnahmen Ärzte ihren Patienten erhebliche Mengen Blut in der Annahme, dadurch verschiedene Krankheiten zu kurieren. In Wirklichkeit schadet ein Blutverlust fast allen Kranken,10 außer sie leiden an Hämochromatose. Der Grund dafür, dass ein Aderlass bei Hämochromatose hilft, ist einfach: Rote Blutkörperchen enthalten eine Menge Eisen. Wenn man sie mit einem therapeutischen Aderlass entfernt, ist der Körper gezwungen, neue Blutkörperchen zu bilden. Dafür braucht er Eisen, das er aus seinem Vorrat holt. Dadurch sinkt der Eisengehalt des Körpers.11 Deshalb gibt es kaum Streit darüber, wie man Hämochromatose behandelt, wohl aber darüber, wie man sie diagnostiziert.
Hämochromatose wurde in den dreißiger Jahren als Erbkrankheit erkannt, etwa sechzig Jahre, bevor der Gendefekt identifiziert wurde.12 Es gibt sogar mehrere Genmutationen, die Hämochromatose verursachen können; aber die häufigste, C282Y genannt, wurde 1996 entdeckt. Sie ist recht interessant, denn es handelt sich um einen Defekt in einem Gen, das die Bildung eines Proteins veranlasst, das seinerseits die Eisenspeicherung reguliert. Da die Hämochromatose eine autosomal-rezessive Krankheit ist, müssen Sie den Gendefekt von beiden Elternteilen erben, um zu erkranken – wie bei der Mukoviszidose. Das geschädigte und das normale Gen unterscheiden sich nur in einem einzigen von fast zehntausend Bausteinen – dort, wo ein G sein sollte, befindet sich ein A. Man nimmt an, dass dieser Defekt auf eine zufällige Mutation bei einem einzigen Wikinger in Nordwesteuropa vor etwa zweitausend Jahren zurückzuführen ist. Sie beeinträchtigt die Fortpflanzungsfähigkeit nicht und hat vielleicht sogar den Vorteil, dass sie Eisenmangel verhindert, vor allem bei menstruierenden Frauen. Dies könnte der Grund dafür sein, dass die Mutation sich über viele Generationen hinweg behaupten konnte.
Gentests für Hämochromatose haben das Leben vieler Ärzte zweifellos komplizierter gemacht. Jetzt müssen wir überlegen, wann wir einen Patienten testen lassen sollen, wie Abbildung 9.2 zeigt. Sollen wir den Test vornehmen, sobald der Genotyp feststellbar ist, also schon vor Ihrer Geburt oder gar kurz nach Ihrer Zeugung? Oder sollen wir nur dann testen, wenn eine biochemische Abweichung, nämlich eine übermäßige Eisenspeicherung vorliegt (der symptomlose Phänotyp) oder erst später, wenn Symptome der Krankheit auftreten (Herzversagen, Leberzirrhose, Diabetes, Nebennierenschwäche, Arthritis oder ein allgemeines Krankheitsgefühl)?
Die Tatsache, dass es drei mögliche Testverfahren gibt, hat unter den Medizinern einige Debatten darüber ausgelöst, welche Methode die beste ist. Meist wird die Diagnose bei einem Patienten gestellt, der müde ist, sich krank fühlt und Gelenkschmerzen hat und dessen Eisenspeicher sich als zu hoch herausstellen. Manche Ärzte treten für eine frühere Diagnose ein; sie wollen auch nach dem symptomlosen Phänotyp mit übermäßiger Eisenspeicherung suchen. Ein einfacher Bluttest kann die Proteine bestimmen, die Eisen resorbieren oder speichern. Andere Ärzte befürworten einen Gentest; sie wollen Menschen routinemäßig auf C282Y und andere genetische Varianten testen. Die Entscheidung ist immerhin so folgenreich, dass die amerikanische Preventive Services Task Force sich zu einer Empfehlung entschloss. In ihrer systematischen Analyse der medizinischen Literatur weist sie darauf hin, dass das Gen C282Y im Gegensatz zur Mukoviszidose nicht vollständig penetrant ist. Sie erkennt sogar an, dass das Konzept der Penetranz viel komplizierter ist. Es war nicht klar, ob mit Penetranz die Wahrscheinlichkeit gemeint ist, mit der das Gen zum symptomatischen Phänotyp (zur Krankheit) führt, oder die Wahrscheinlichkeit, mit der es zum symptomlosen Phänotyp mit übermäßiger Eisenspeicherung führt.
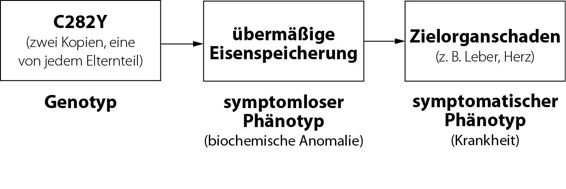
Abbildung 9.2 Drei Punkte, an denen Hämochromatose diagnostiziert werden kann
Die PSTF prüfte beide Wahrscheinlichkeiten und kam zu dem Schluss, dass die Penetranz vom Genotyp zum symptomlosen Phänotyp und erst recht vom Genotyp zum symptomatischen Phänotyp unvollständig ist. Weniger als die Hälfte der Menschen, die C282Y von beiden Elternteilen geerbt haben, leiden unter der biochemischen Anomalie einer übermäßigen Eisenspeicherung, und weniger als die Hälfte derer, bei denen eine übermäßige Eisenspeicherung vorliegt, bekommen den klinischen Befund.13 Abbildung 9.3 zeichnet ein genaueres Bild der Abweichung.
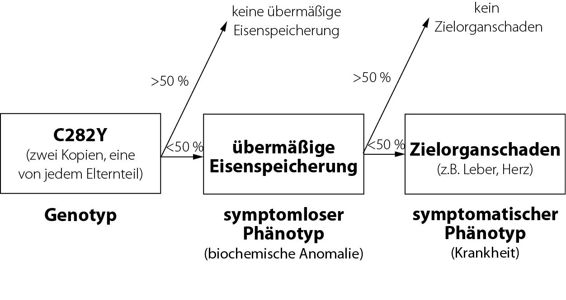
Abbildung 9.3 Penetranz der Hämochromatose
Kurz gesagt: Von vier Menschen, die von beiden Elternteilen C282Y geerbt haben, erkranken etwa drei nicht an Hämochromatose. Wenn wir Menschen auf diesen Genotyp testen, sind also 75 Prozent derjenigen, bei denen die genetische Anomalie vorliegt, Opfer einer Überdiagnose.
Nun könnte man durchaus die Meinung vertreten, dass wir diese drei Opfer akzeptieren können, wenn klar ist, dass der Eine, bei dem sich die Krankheit entwickelt, von der frühen Diagnose profitiert. Andererseits wäre es ebenso vernünftig zu fordern, dass Patienten die Möglichkeit haben sollten, selbst zu entscheiden, ob sie getestet werden oder nicht. Sie müssten dann den potenziellen Nutzen einer frühen Diagnose der Krankheit abwägen gegen den potenziellen Schaden einer Überdiagnose, zum Beispiel Verlust der Versicherung (in den USA) oder unnötige Aderlässe. Damit jedoch ein Patient, der eines Tages an Hämochromatose erkranken wird, von einem Gentest profitiert, muss eine frühe Behandlung eindeutig besser sein als eine Behandlung aufgrund einer Diagnose, die sich auf Symptome stützt. Die PSTF fand keinerlei Beweise dafür, dass ein früherer Behandlungsbeginn den wenigen Patienten nützen würde, bei denen sich die Krankheit entwickeln wird. Und da die Krankheit relativ selten ist, müssten wir ungefähr tausend Menschen genetisch testen, um eine kranke Person zu finden. Dann läge bei drei Menschen eine Überdiagnose vor, und andere müssten einen falschen Alarm ertragen, weil das defekte Gen bei ihnen irrtümlicherweise diagnostiziert würde. Die PSTF riet daher dingend vom Gentest ab und kam zu dem Schluss, dass die möglichen Nachteile die möglichen Vorteile überwiegen. Bis auf Weiteres wird der Aderlass also keine Auferstehung als gängige Therapie erleben.
Gentests für häufige Krebsarten
Hämochromatose ist eine ziemlich seltene Krankheit. Sie ist nicht der Grund dafür, dass so viele Leute sich von Gentests begeistern lassen. Was sie wirklich interessiert, ist die Bestimmung des Risikos für häufige chronische Krankheiten wie Diabetes, Herzkrankheiten und Krebs. Das Interesse am Krebs scheint bei Weitem am größten zu sein. Wir haben bereits eine recht gute Vorstellung davon, bei wem das Risiko für Diabetes und Herzkrankheiten hoch ist. Es besteht kein Bedarf an einem Gentest, der die gängigen und wichtigen Risikofaktoren für Diabetes ermittelt: Fettleibigkeit, eine sitzende Lebensweise sowie die familiäre Belastung. Wir brauchen auch keinen Gentest für Herzkrankheiten und ihre wichtigen Risikofaktoren: hoher Cholesterinspiegel, Bluthochdruck, Diabetes und familiäre Belastung. Aber Krebs ist etwas anderes. Rauchen ist der einzige häufige und wichtige Risikofaktor, aber nur für einige Krebsarten. Und auch Nichtraucher erkranken oft an Krebs.
Die meisten Karzinome treten offenbar sporadisch auf, fast zufällig. Es gibt zwar einzelne Gene, die Krebs verursachen, zum Beispiel das BRCA1- und das BRCA2-Gen beim Eierstockkrebs und beim Brustkrebs sowie das Gen für familiäre adenomatöse Polypose, die zu Dickdarmkrebs führt, aber diese Gene sind insgesamt nur für relativ wenige Karzinome verantwortlich. Die meisten Brust-, Eierstock- und Darmkarzinome haben keine leicht identifizierbare genetische Grundlage. Das Gleiche gilt auch für andere Krebsarten. Trotzdem wird mit viel Begeisterung (und Geld) versucht, die mögliche genetische Mitursache häufiger Krebsarten zu finden. Warum auch nicht? Diese Forschung ist ja vielversprechend. Wenn wir bestimmen können, wer wahrscheinlich Krebs bekommt, können wir die Betroffenen anders behandeln und möglicherweise mehr Leben retten.
Aber es gibt zwei Probleme bei dieser Herangehensweise. Erstens ist nicht klar, inwiefern wir diese Patienten anders behandeln sollen. Suchen wir nur intensiver nach Krebs, trotz aller Probleme, die damit verbunden sind? Oder tun wir wirklich etwas – verabreichen wir ein Medikament, oder operieren wir? Die Wahrheit lautet: Das ist sehr schwer zu sagen. Und wenn wir mithilfe einer Studie herausfinden wollen, welcher Ansatz der beste ist, müssen wir Tausende von Patienten jahrzehntelang beobachten.
Das zweite Problem sind natürlich Überdiagnosen. Wir sagen möglicherweise zu vielen Menschen, dass ihr Krebsrisiko hoch sei. Dann machen sie sich nicht nur unnötige Sorgen, sondern sie werden obendrein untersucht und behandelt. Das kann ihnen nur schaden.
Die intensive Suche nach Krebsrisiken
Die Forscher haben auf ihrer Suche nach den genetischen Mitursachen häufiger Krebsarten einen neuen Kurs eingeschlagen. Sie wissen, dass meist kein einzelnes Gen für einen Krebs verantwortlich ist (solche Gene wären im Stammbaum leicht erkennbar). Darum studieren sie die Rolle mehrerer Gene bei der Krebsentstehung. Oft wissen sie nicht genau, welche Gene das sind, wo sie sich befinden oder ob sie überhaupt existieren. Trotz dieser Ungewissheit wenden sie eine ziemlich schlaue Methode an. Sie suchen nach Snips. Snips ist die phonetische Aussprache der Abkürzung SNPs, die für single nucleotide polymorphisms (einzelne Nukleotidpolymorphismen) steht. Ein Snip ist eine Genvariante in einem einzigen Baustein der gesamten DNS. Wenn die meisten Menschen einen bestimmten DNS-Abschnitt haben, der AATGGGC lautet, während bei Ihnen die Reihenfolge AATTGGC vorliegt, haben Sie einen Snip.
Jedes Genom enthält zahlreiche Snips. Einige kommen in der Mitte eines Gens vor und beeinflussen seine Funktion (zum Beispiel C282Y bei Hämochromatose). Die meisten Snips befinden sich jedoch in der »Junk-DNS«, die keine bekannte Funktion hat. Ein Teil dieses »Erbgutmülls« besteht vielleicht aus evolutionären Artefakten, die früher einmal einen Zweck erfüllten, heute aber nicht mehr. Ein anderer Teil dient möglicherweise als Ablage für Genvarianten, die in Zukunft nützlich sein können, oder er hat eine Funktion, die wir noch nicht kennen. Es hat sich herausgestellt, dass die DNS zum größten Teil aus Müll besteht. Obwohl wir also eine Menge Snips im Genotyp haben, spielt das kaum eine Rolle, weil die meisten Snips den Genotyp nicht beeinflussen.14
Snips sind ziemlich leicht zu finden. Wissenschaftler können individuelle Genome rasch miteinander vergleichen und die Snips aufspüren. Snips kann man sich als einzelne Schilder auf dem Genom vorstellen, als Wegweiser, die möglicherweise mit der benachbarten funktionellen DNS (dem DNS-Teil mit den Genen) in Verbindung stehen. Insofern gleichen Snipmuster den Strichcodes. Obwohl die meisten Snips untätig bleiben (nicht kodieren), könnten ihre Muster etwas über die funktionelle DNA verraten, also auch über Krankheitsrisiken. Um herauszufinden, ob Snipmuster Krebs vorhersagen, vergleichen Wissenschaftler die Snipmuster Hunderter von Krebspatienten mit den Snipmustern Hunderter gesunder Menschen. Dann versuchen sie mit Großcomputern eine Formel zu finden, die für eine Snipkombination steht, mit der man am besten zwischen Krebskranken und Gesunden unterscheiden kann. Mit anderen Worten: Sie sammeln in einer großen Bevölkerungsgruppe genetische Strichcodes und suchen nach einer Strichcode-Formel, die zwischen Krebskranken und Gesunden unterscheiden kann. Das ist seriöse statistische Arbeit, die ohne moderne Computer unmöglich wäre.
Fallstudie: Snips und Prostatakrebs
Die prototypische Studie zu diesem Thema erschien im Februar 2008 im New England Journal of Medicine.15 Sie kam zu dem Ergebnis, dass eine Kombination von fünf Snips helfen kann, das Prostatakrebsrisiko einzuschätzen. Die Forscher suchten bei Männern mit und ohne Prostatakrebs nach insgesamt sechzehn Snips. Andere Wissenschaftler hatten behauptet, alle sechzehn stünden mit Prostatakrebs in Verbindung; aber diese Studie belegt, dass drei dieser Snips nichts mit der Krankheit zu tun haben. Die Studie sollte uns eine Lehre sein: Wir können heutzutage so viele Snips lesen, dass einige von ihnen scheinbar mit Krankheiten zusammenhängen, obwohl es sich nur um eine zufällige Korrelation handelt. Denken Sie daran, dass die meisten Snips nichts kodieren und selbst keinen Krebs verursachen. Zwischen ihnen und dem Krebs besteht nur ein statistischer Zusammenhang, und das kann reiner Zufall sein. Bevor wir also an eine ursächliche Verbindung zwischen Snips und einer Krankheit glauben, sollte diese von mehreren Studien bestätigt worden sein.
Die Wissenschaftler suchten dann die fünf Snips heraus, die am stärksten mit Prostatakrebs korrelierten. Allerdings hing jeder einzelne Snip (in den Worten der Autoren) »nur moderat mit Prostatakrebs zusammen«. Das heißt, jede einzelne Genvariante war schwach penetrant. Darum beschlossen die Forscher, die kumulative Wirkung mehrerer Snips zu untersuchen. Das Ergebnis war ein offenbar starker Zusammenhang: Männer, die vier oder alle fünf dieser Snips besitzen, bekommen 4,5 Mal häufiger Prostatakrebs. Die Wissenschaftler waren begeistert und verkündeten in ihrer Presseerklärung: »Zum ersten Mal eröffnet eine Studie dieser Art die Chance, einen klinisch brauchbaren Gentest zu entwickeln.« Außerdem beschlossen sie, eine Firma zu gründen und den Test zu vermarkten.
Aber die potenziellen Kunden sollten das Wort brauchbar in diesem Fall mit einer gesunden Portion Skepsis betrachten. Es könnte bedeuten, dass der Test durchführbar ist. Es könnte auch bedeuten, dass der Test sich lohnt. Und natürlich sind wir daran interessiert, ob die letztere Behauptung stimmt, selbst wenn die Forscher etwas anderes gemeint haben.16
Nehmen wir also an, Sie besitzen den ungünstigen Snip-Strichcode, also vier oder alle fünf Snips. Ihr Arzt sagt Ihnen, Ihr Prostatakrebsrisiko sei 4,5 Mal höher. Höher als was? Wie sich herausstellt, bestand die Vergleichsgruppe in dieser Studie aus Männern ohne einen dieser Snips. Aber Snips sind weitverbreitet, und die meisten Menschen besitzen sie. Ein Mann, der keinen einzigen dieser fünf Snips aufweist, ist eine Seltenheit. Unter den Männern, die an der Studie teilnahmen, gehörten nur 10 Prozent in diese Kategorie. Wenn Sie Ihr Risiko genau einschätzen wollen, sollten Sie sich mit einem Durchschnittsmann vergleichen, der zwei Snips besitzt.
Tabelle 9.1 zeigt, dass die Vergleichsgruppe, die man wählt, um das Risiko zu berechnen, eine große Rolle spielt.
Tabelle 9.1 Verschiedene Vergleichsgruppen und das Prostatakrebsrisiko
|
Zahl der Snips |
Prostatakrebsrisiko im Vergleich zu Männern mit dem geringsten Risiko (0 Snips) |
Prostatakrebsrisiko im Vergleich zum »Durchschnittsmann« (2 Snips) |
|
0 |
Vergleichsgruppe |
50 % niedriger |
|
1 |
1,5 Mal höher |
25 % niedriger |
|
2 |
2 Mal höher |
Vergleichsgruppe |
|
3 |
2,2 Mal höher |
1,1 Mal höher |
|
4 oder mehr |
4,5 Mal höher |
2,3 Mal höher |
Da die Vergleichsgruppe in dieser Studie aus Männern ohne Snips bestand, hat jeder, der ein oder mehr Snips besitzt, ein erhöhtes Risiko. Wir sollen glauben, ein Mann mit zwei Snips habe ein doppelt so hohes Prostatakrebsrisiko. In Wirklichkeit hat ein Mann mit zwei Snips ein durchschnittliches Risiko. Um das relevante Risiko zu berechnen, das Risiko, an dem wir wirklich interessiert sind, müssen wir diesen Durchschnittsmann als Vergleichsmaßstab benutzen. Nur dann können andere Testergebnisse das Risiko erhöhen oder senken, und das Risiko von niemandem ist 4,5 Mal höher. Wie Sie aus der Tabelle ersehen, kann Ihr ungefähres Risiko schlimmstenfalls doppelt so hoch und bestenfalls halb so hoch sein wie das Risiko eines Durchschnittsmannes.
An Prostatakrebs zu erkranken ist natürlich nicht dasselbe wie daran zu sterben. Seitdem der PSA-Test eingeführt wurde, beginnen wir, das große Reservoir dieser Krankheit in der Gesamtbevölkerung anzuzapfen, wobei zweifellos einige Diagnosen und Behandlungen unnötig sind. Mit anderen Worten: Viele der Männer, die an Prostatakrebs erkranken, sterben nicht daran. Gentests werden dieses Problem wahrscheinlich nicht lösen. Manche Männer mit Prostatakrebs in der Snip-Studie hatten einen sehr aggressiven Krebs, andere einen sehr langsam wachsenden. Aber die Snips konnten nicht zwischen diesen beiden unterscheiden. Die Snips konnten nicht vorhersagen, welche gesunden Männer in jungen Jahren Prostatakrebs bekommen würden oder welche Männer ein Karzinom hatten, das sich bereits über die Prostata hinaus ausgebreitet hatte. Sie konnten weder den Gleason-Grad (damit drücken Pathologen aus, wie aggressiv Zellen unter dem Mikroskop aussehen) noch den PSA-Wert (das biochemische Maß für die Aggressivität eines Karzinoms) vorhersagen. Sie konnten nicht einmal vorhersagen, bei wem eine familiäre Belastung mit Prostatakrebs vorlag (das überrascht, denn man sollte meinen, diese Information sei im Genom enthalten). Zwar half der Test anscheinend, das Prostatakrebsrisiko vorherzusagen, aber er sagte nichts darüber aus, welche Männer an aggressivem (und möglicherweise tödlichem) Prostatakrebs erkranken und welche einen dauerhaft symptomlosen Prostatakrebs bekommen würden.
Die Information über das Risiko, die der Test liefert, ist nicht besonders nützlich. Wenn wir Männern lediglich sagen, ihr Prostatakrebsrisiko sei erhöht, öffnen wir Überdiagnosen und unnötigen Behandlungen Tür und Tor. Snips können uns nicht sagen, was für uns am wichtigsten ist: Bei welchem Mann ist das Risiko, an Prostatakrebs zu sterben, hoch?
Allerdings kann es durchaus sein, dass eine neue Studie eine Kombination von Snips identifiziert, die das Sterberisiko bei Prostatakrebs vorhersagt. Dann würden manche Männer zu hören bekommen, ihr Risiko, an Prostatakrebs zu sterben, sei etwa doppelt so hoch; anderen würde man versichern, ihr Risiko sei nur halb so hoch. Die bei Weitem häufigsten Testergebnisse würden jedoch kleinere Risikoveränderungen widerspiegeln: 1,1 Mal höher, keine Veränderung oder 25 Prozent niedriger. Alle diese Informationen – doppeltes und halbes Risiko und so weiter – sind relativ. Mit dem relativen Risiko vergleicht man das Risiko in zwei unterschiedlichen Gruppen; sein Nutzen hängt davon ab, wie viele Menschen erkrankt sind und wie selten oder häufig eine Krankheit vorkommt. Es ist ein Unterschied, ob wir eine hohe Zahl verdoppeln oder ob wir eine kleine Zahl verdoppeln. Diese Zahl, das absolute Risiko, ist das durchschnittliche Risiko, während eines bestimmten Zeitraums zu erkranken. Tabelle 9.2 fasst die beiden Maßstäbe kurz zusammen und nennt zudem eine spezifische Art von Risiko: das Lebenszeitrisiko.
Tabelle 9.2 Relatives, absolutes und Lebenszeitrisiko
|
Maß |
Beschreibung |
Beispiel |
|
Relatives Risiko |
Das bekannteste Maß für das Risiko, eigentlich das Verhältnis zweier absoluter Risikenw (eines relativ zum anderen). |
Das Prostatakrebsrisiko von Herrn X ist doppelt so hoch wie das eines Durchschnittsmannes. |
|
Absolutes Risiko |
Die Wahrscheinlichkeit, dass etwas geschieht. Um vollständig zu sein, muss das absolute Risiko den Zeitraum einschließen, auf den die Wahrscheinlichkeit sich bezieht. |
Für den durchschnittlichen 50-jährigen Amerikaner beträgt das Risiko, in den nächsten zehn Jahren an Prostatakrebs zu sterben, 0,1 Prozent (einer je tausend). |
|
Lebenszeitrisiko |
Das absolute Risiko innerhalb eines bestimmten Zeitraumes – Ihres restlichen Lebens |
Für den durchschnittlichen Amerikaner beträgt das Risiko, während seines Lebens an Prostatakrebs zu sterben, 3 Prozent. |
Das absolute Risiko für den Tod durch Prostatakrebs im Laufe des Lebens – das Lebenszeitrisiko – beträgt etwa 3 Prozent. Für den Durchschnittsamerikaner beträgt demnach das Risiko, an Prostatakrebs zu sterben, 3 Prozent. Angenommen, es gäbe einen Gentest, der die Prostatakrebssterblichkeit vorhersagen könnte, dann könnte er so aussehen: Wenn Sie vier oder mehr Snips besitzen, ist Ihr Lebenszeitrisiko 2,3 Mal höher als 3 Prozent, also 6,9 Prozent. Wenn Sie keines der fünf Snips besitzen, ist Ihr Lebenszeitrisiko die Hälfte von 3 Prozent, also 1,5 Prozent.
Einerlei, wie viele Snips Sie haben, Ihr Risiko, an etwas anderem als an Prostatakrebs zu sterben, ist immer höher als 90 Prozent.
Stellen wir uns nun einen Mann in den Zwanzigern vor, der erfährt, dass er vier oder mehr Snips hat. Was soll er anders machen? Ist ein Lebenszeitrisiko von 6,9 Prozent hoch genug, um eine endgültige Therapie zu rechtfertigen, also die Entfernung der Prostata? Die meisten Männer würden sich wohl dagegen entscheiden, weil als Nebenwirkung Impotenz droht. Soll er mit einer Hormontherapie beginnen? Wahrscheinlich nicht. Sie kann zu erektiler Dysfunktion und zu einer Brustvergrößerung führen. Ihm bleibt also nur eine Wahl: Er muss versuchen, die Krankheit mithilfe von PSA-Tests im Frühstadium zu entdecken. Allerdings wissen wir immer noch nicht, ob PSA-Tests die Zahl der Todesfälle durch Prostatakrebs verringern. Viele Männer und Ärzte glauben daran. Aber wenn Sie daran glauben, würden Sie sich dann nicht ohnehin testen lassen, einerlei, ob Ihr Risiko 6,9 Prozent, 1,5 Prozent oder etwas dazwischen beträgt? Und wenn Sie nicht an den PSA-Test glauben und sich Sorgen wegen der Überdiagnosen und Überbehandlungen machen, die der PSA-Test mit sich bringt, würde die kleine Veränderung Ihres Risikos Ihre Meinung ändern? Was Gentests anbelangt, lautet die wichtigste Einschränkung, die wir machen müssen: Ihre Ergebnisse haben bestenfalls eine relativ kleine Auswirkung auf das geschätzte Risiko für künftige Krankheiten, aber bestimmt keinen so großen Einfluss, dass Sie Ihre Einstellung – das, was Sie ohnehin tun (oder tun sollten) – ändern würden.
»Was nun?«
Die Frage, was wir mit den Informationen anfangen sollen, die Gentests uns liefern, ist von großer Bedeutung. Denken Sie an die durchschnittliche zwanzigjährige Frau, die ihren ersten Genom-Scan hinter sich hat. Ihr Risikoprofil (es nennt relative Risiken) zeigt ein viermal höheres Eierstockkrebsrisiko, ein niedrigeres Lungenkrebsrisiko und ein erhöhtes Brustkrebsrisiko (hier sind die Daten jedoch unklar). Außerdem ist ihr Risiko, herzkrank zu werden, erhöht, und sie hat Genvarianten, die ihr Risiko für eine Makuladegeneration sowohl verringern als auch erhöhen. Wir haben eine Menge Informationen, aber keinen Hinweis auf die praktischen Konsequenzen. Was nun? Manche würden vielleicht sagen, zuerst müsse das erhöhte Risiko für Eierstockkrebs angegangen werden, vielleicht durch Entfernung der Eierstöcke. Andere würden einwenden, das absolute Risiko für Eierstockkrebs sei ziemlich gering. Bei einer Durchschnittsfrau beträgt das Risiko, während ihres Lebens an Eierstockkrebs zu sterben, etwa 1 Prozent; in unserem Beispiel läge es also bei nur 4 Prozent. Man könnte daher argumentieren, es sei wahrscheinlicher, dass diese Frau durch Herzversagen stirbt, obwohl ihr Risiko nur durchschnittlich hoch ist (das Lebenszeitrisiko für Tod durch Herzkrankheit beträgt bei einer Durchschnittsfrau über 20 Prozent). Die Entfernung der Eierstöcke würde die Produktion von Östrogen drastisch verringern und das Risiko für Herzkrankheiten erhöhen. Ein anderer Arzt würde vielleicht vorschlagen, die Eierstöcke operativ zu entfernen und mit einer Östrogen-Ersatztherapie zu beginnen.17 Und schließlich würde jemand bestimmt darauf hinweisen, dass dieser Eingriff ihr Brustkrebsrisiko erhöht. Wegen dieser Ungewissheiten und weil ihr eine Anomalie für erhöhtes Lungenkrebsrisiko fehlt, ist unsere Patientin versucht, Raucherin zu werden.
Welches ist der richtige Ansatz? Mit dem Rauchen sollte sie nicht anfangen – aber ich fürchte, das ist der einzige Punkt, über den die Ärzte sich einig wären. Es ist eine Ironie, dass ein Gentest, der ein unterdurchschnittliches Risiko für eine bestimmte Krankheit belegt, seine eigenen Probleme aufwirft. Er könnte nämlich dem Betroffenen ein falsches Sicherheitsgefühl vermitteln, sodass er die wichtigsten Regeln für eine gesunde Lebensweise missachtet. Was wir mit den übrigen Informationen anfangen sollen, wissen wir nicht.
Unsere Fähigkeit, das Genom zu entziffern, ist unserer Fähigkeit, die Befunde medizinisch vernünftig zu interpretieren, vorausgeeilt. Das genetische Risiko ist letztlich nur ein Faktor von vielen, die das Krankheitsrisiko bestimmen (denken Sie daran, dass die Gene, die Umwelt und der Zufall entscheiden). Auf diese Weise hilft medizinische Intervention einigen wenigen Menschen, die auf jeden Fall erkranken werden; aber wir behandeln mit Sicherheit viele andere wegen einer Krankheit, die sie nie bekommen werden oder die nie Symptome hervorrufen wird.
Es wird noch lange dauern, bis wir wissen, was wir mit genetischen Informationen anfangen sollen. Dafür sind große Studien notwendig, die sich über Jahrzehnte hinziehen und an denen Zehntausende von Menschen mit jeder genetischen Variante teilnehmen. Eine Gruppe müsste behandelt werden, die andere nicht. Bei einigen Varianten mag eine Behandlung sich als nützlich erweisen. Bei anderen wird der Schaden größer als der Nutzen sein. Oft werden die Ergebnisse schlicht unklar sein, und die Wissenschaftler werden dann weitere Studien verlangen. Aber rechnen Sie nicht mit Antworten. Vielleicht werden wir nie wissen, welche medizinischen Maßnahmen aufgrund eines Gentests zu ergreifen sind. Die Ursache hierfür sind die innovativen Prozesse in der Medizin. Medizinische Theorien bleiben selten mehrere Jahrzehnte lang unverändert; aber dies ist die Zeitspanne, die wir für Langzeitstudien benötigen. Krankheiten werden neu definiert, und Therapien entwickeln sich schnell weiter. Das bedeutet, dass Ideen und technische Verfahren in der medizinischen Praxis entstehen und vergehen, lange bevor die klinisch relevante Wissenschaft uns sagen kann, was wir tun sollen. Nur eines ist gewiss: Gentests führen zwangsläufig zu Überdiagnosen.
Warum die Suche nach Krebsgenomen das Problem der Überdiagnose nicht unbedingt löst
Bisher habe ich mich nur mit Tests befasst, die im Genom von Individuen nach Anomalien suchen, um vorherzusagen, wie hoch das Risiko für bestimmte Krankheiten ist. Inzwischen untersuchen Mediziner aber auch mit großer Begeisterung das Genom einzelner Karzinome – nicht das Genom des Patienten, sondern das Genom seines Karzinoms. Ein Krebs hat nämlich sein eigenes Genom, das sich von dem des Kranken unterscheidet. Denken Sie daran, dass genetische Mutationen Krebs auslösen.
Manche Leute glauben, dass wir alle genetischen Informationen in einzelnen Karzinomen entschlüsseln und eines Tages entscheiden können, welche Karzinome aggressiv und tödlich sind und daher behandelt werden müssen und welche wir besser in Ruhe lassen, weil sie nie Probleme verursachen werden. Das würde scheinbar das Dilemma der Überdiagnose beseitigen, weil wir die Karzinome finden und behandeln könnten, die das Leben des Patienten bedrohen. Dieser Ansatz ist zwar vielversprechend, aber er müsste große Hindernisse überwinden.
Es hat sich herausgestellt, dass die meisten Krebsarten mehr als ein genetisches Mutationsmuster aufweisen. Viel mehr. Um eine zuverlässige Prognose auf ein bestimmtes genetisches Mutationsmuster bei einem bestimmten Karzinom zu stützen, müssen wir zahlreiche Karzinome mit dem gleichen Muster beobachten. Aber es gibt so viele Muster, dass wir möglicherweise nicht genügend Karzinome mit dem gleichen Muster finden. Der Titel eines Vortrags, der kürzlich auf einer Konferenz im amerikanischen Nationalen Krebsinstitut gehalten wurde, spiegelt das Problem der genetischen Vielfalt beim Krebs treffend wider: »50 000 Tumore, 40 000 Abweichungen«.18 Die unbequeme Wahrheit lautet: Die genetischen Informationen in einem Karzinom sind möglicherweise zu variabel, als dass wir die Entwicklung irgendeines Karzinoms vorhersagen könnten.
Ähnlich verhält es sich mit der Prognose für Krebspatienten. Um herauszufinden, ob sie nicht-invasive Karzinome haben, die man besser in Ruhe lässt, müssten wir zahlreiche Krebspatienten beobachten, ohne sie zu behandeln. Das ist schon geschehen, vor allem in Studien über Prostatakrebs. Aber es wäre sehr schwierig, genügend Patienten mit jeder Krebsart und mit jedem Mutationsmuster für jede dieser Krebsarten zu finden, die bereit wären, so lange auf eine Therapie zu verzichten, bis wir genau wüssten, wie der Krebs sich entwickelt.
Nehmen wir aber an, wir hätten genügend Karzinome und genügend bereitwillige Patienten, um die künftige Entwicklung jedes Mutationsmusters vorherzusagen. Dann stünden wir immer noch vor einem Problem: Das Genom eines Karzinoms kann sich ändern. Ein veränderliches Genom ist sogar in vielerlei Hinsicht ein typisches Krebsmerkmal; denn Krebszellen teilen sich schnell und replizieren ihr Genom willkürlich, wobei sich die Mutationen mit der Zeit häufen. Da Krebsgenome von Natur aus instabil sind, spiegelt ein heute vorgenommener Test eines Krebsgenoms nicht unbedingt das morgige Krebsgenom wider. Das heißt, dass auch die prognostizierte Entwicklung eines Karzinoms sich durchaus ändern kann. Zudem ist Krebs wie alle Krankheiten nicht allein genetisch bedingt. Denken Sie daran: Dieselbe DNS kann unter verschiedenen Umweltbedingungen verschiedene Phänotypen hervorbringen. Die Entwicklung eines Karzinoms spiegelt also nicht nur sein Genom wider, sondern auch die Umwelt, in der es wächst – das Milieu seines Wirtes. Selbst wenn wir das Genom eines Karzinoms vollständig entziffern könnten und wüssten, wie es sich in Zukunft verändern wird, blieben noch viele Unbekannte übrig.
Ich bestreite nicht, dass die Bestimmung von Krebsgenomen in einigen Fällen nützlich sein wird. Wahrscheinlich hat eine kleine Untergruppe von genetischen Varianten bei manchen Karzinomen eine so große Wirkung auf künftige Risiken, dass man sie identifizieren und nutzen kann. Ich vermute jedoch, dass diese genetischen Informationen hauptsächlich die Entscheidung beeinflussen werden, wie aggressiv eine Behandlung sein sollte (zum Beispiel, ob einer Operation eine Chemotherapie folgen sollte). Um das Problem unnötiger Therapien bei den Opfern von Überdiagnosen zu lösen, brauchen wir einen Test, der eine grundlegendere Frage beantwortet: Ist eine Behandlung überhaupt notwendig?
Obwohl die meisten Menschen einen normalen Phänotyp haben, sind genetische Anomalien bei fast allen zu finden. Bei jedem Menschen kann man ein hohes Risiko für irgendeine Krankheit nachweisen. Deshalb könnten die neuen persönlichen Gentests uns alle krank machen und zur ergiebigsten Quelle für Überdiagnosen werden. Die Wahrscheinlichkeit ist sehr hoch, dass die Wissenschaftler all jene Gene bereits entdeckt haben, die eindeutig zum Ausbruch einer Krankheit führen, zum Beispiel die Gene für Mukoviszidose und für die Huntington-Krankheit. Und wahrscheinlich haben sie fast alle Gene entdeckt, die Krankheiten zwar nicht mit Sicherheit auslösen, aber ihre Wahrscheinlichkeit stark erhöhen – zum Beispiel die BRCA-Gene. Jetzt suchen die Forscher vor allem Genvarianten mit viel geringeren Wirkungen, die das Risiko für Krebs, Herzkrankheiten, Diabetes, altersbedingte Makuladegeneration und andere Krankheiten ein wenig erhöhen oder senken. Aber nicht immer ist klar, was wir eigentlich vorhersagen. Und noch weniger klar ist, was wir mit den Vorhersagen anfangen sollen.
Natürlich hängen die Folgen all dieser Überdiagnosen unmittelbar davon ab, wie wir mit den Informationen umgehen. Wenn wir niemandem etwas sagen würden, würde niemand etwas anders machen, und es gäbe kein Problem. Dann aber wäre der Test sinnlos. Vielleicht könnten wir sämtliche kleinen Risikoveränderungen ignorieren und nur über die wenigen wirklich großen sprechen. Dann könnten die Forscher sich damit befassen, welche Maßnahmen den Menschen mit dem höchsten Risiko wirklich helfen.
Das wäre zwar das beste Szenario, aber ich fürchte, es wird nie eintreten. Das Problem ist, dass es uns sehr schwerfällt, Informationen zu ignorieren. Wenn Sie erst einmal wissen, dass mit Ihrer Gesundheit etwas nicht stimmt, stehen Sie unter großem Druck, etwas zu unternehmen. Und wenn nicht klar ist, was Sie tun sollen, können Sie darauf wetten, dass diese Informationen zu einer Serie von willkürlichen Maßnahmen mit unbekannten Vorteilen und unerwarteten Nachteilen führen werden. Ganz zu schweigen davon, dass die Informationen vielen Menschen Angst einjagen.
Aber wird die Gesellschaft wirklich gesünder, wenn wir Gesunde über ihre Krankheitsrisiken informieren? Ist es gesund, wenn junge Menschen sich Jahre vor ihrem Tod intensiv mit ihrer wahrscheinlichen Todesursache beschäftigen? Übrigens müssen wir mit Gentests nicht warten, bis wir zwanzig sind; wir könnten damit – wie mit den Cholesterintests – schon bei Kindern oder sogar bei Ungeborenen beginnen. Nichts kann uns daran hindern, Informationen über das Sterberisiko eines Menschen zu sammeln, noch ehe er geboren wird.19 Die Ironie dieser Geschichte aber ist, dass die gesündesten Bevölkerungsgruppen möglicherweise diejenigen sind, die nichts über ihre DNS wissen.