16. LOS ELEMENTOS ARTIFICIALES
El hombre al fin había comprendido suficientemente bien los elementos como para hacerlos propios. En el siglo XX, el hombre se convirtió en un alquimista que sabía lo que estaba haciendo… hasta cierto punto…
En primer lugar, quedaba pendiente lo de aquellos cuatro elementos que aún estaban ausentes de la tabla periódica. El hecho era que, prácticamente, también habían desaparecido de la Naturaleza. Los científicos tuvieron que hacer ellos mismos aquellos elementos para poder estudiarlos.
Como ya hemos mencionado, en 1919, Ernest Rutherford cambió el nitrógeno en oxígeno bombardeando átomos de nitrógeno con partículas alfa. Esto sugirió que lo que había que hacer para alterar un elemento artificialmente, era añadir o sustraer partículas de su núcleo.
Así, pues, el primer isótopo completamente nuevo y artificial fue producido con ayuda del método de Rutherford. Sus creadores fueron Irene Curie, la hija de los famosos Marie y Pierre, y su marido Frédéric Joliot. (Para perpetuar el apellido Curie, Joliot se cambió el suyo en Joliot-Curie, una vez casado con Irene).
Los Joliot-Curie bombardearon aluminio con partículas alfa. Su ataque transformó parte de los átomos de aluminio en una sustancia altamente radiactiva. Esto demostró ser una nueva clase de fósforo. Su peso atómico era de 30, en lugar de 31, que es el del fósforo natural. (Como el descubrimiento del neutrón iba a mostrar más tarde, el núcleo del fósforo 30 tiene 15 neutrones en vez de los 16 del fósforo natural).
No era de extrañar que el fósforo 30 no se presentase en la Naturaleza; su vida media era sólo de dos minutos y medio… A todos los eventos, los Joliot-Curie habían producido «radiactividad artificial» por primera vez. Irene, al igual que su madre antes que ella, recibió el premio Nobel de Física, en 1935, junto con su marido.
RELLENANDO LOS ÚLTIMOS HUECOS
La era de la transmutación artificial comenzó realmente con la fabricación del primer «aplastaátomos» —el ciclotrón—, por Ernest Orlando Lawrence, de la Universidad de California, en 1931. Con el ciclotrón, y con el enormemente más enérgico acelerador de partículas, desarrollado más tarde, se hizo posible abrir los núcleos de cada átomo, para añadirle partículas e incluso crear también partículas nuevas.
El primer elemento producido de esta forma fue el perdido elemento número 43. Se realizó en 1925, por Noddack, Tacke y Berg, los descubridores del renio. Denominaron a este nuevo elemento número 43 «masurio» (por un distrito de la Prusia Oriental). Pero nadie más fue capaz de encontrar el «masurio» en el mismo material de origen, por lo que el supuesto descubrimiento quedó en el aire. En realidad, se trató sólo de un error. En 1937, Emilio Gino Segrè, de Italia, un ardoroso cazaelementos, identificó al auténtico número 43.
Lawrence había bombardeado una muestra de molibdeno (elemento número 42) con protones acelerados en su ciclotrón. Finalmente, consiguió un poco de materia radiactiva, la cual envió a Segrè, en Italia, para su análisis. Segrè y un ayudante, C. Perrier, rastrearon parte de la radiactividad hasta un elemento que se comportaba parecidamente al manganeso. Dado que el elemento número 43 que faltaba pertenece a una vacante, en la tabla periódica, próximo al manganeso, estaban seguros que se trataba de éste.
Pero resultó que el elemento número 43 tenía varios isótopos. Y cosa rara, todos ellos eran radiactivos. En este elemento no existían isótopos estables…
Esto resultaba sorprendente. Cada otro elemento hasta el bismuto (número 83) tenía, por lo menos, un isótopo estable. Nadie podía entender por qué un elemento, con un número atómico tan bajo como el 43, tenía sólo formas radiactivas.
De todos modos, los hechos eran los hechos… El elemento 43 es, en efecto, totalmente inestable. Su isótopo de vida más larga, con un número másico de 99, poseía una vida media de poco más de 200.000 años. Por ello, todos los elementos que hubiesen podido formarse de forma originalmente natural, debían de haberse ya descompuesto al principio de la historia de nuestro planeta, que tiene una antigüedad de varios miles de millones de años.
Segrè llamó al elemento número 43 «tecnecio», de una palabra griega que significaba «artificial», porque se trataba del primer elemento fabricado por el hombre.
El siguiente de los elementos que quedaban por descubrir, fue el número 87. Éste se ha descubierto en la Naturaleza. En 1939, Marguerite Perey, una química francesa, encontró un nuevo tipo de radiación entre los productos de la desintegración radiactiva del actinio. La radiación demostró pertenecer a un elemento que se comportaba de igual forma que un metal alcalino. Por lo tanto, debía de ser el elemento número 87, el miembro perdido de la familia de los alcalinometales. Marguerite Perey lo denominó «francio».
La cantidad de francio que encontró fue sólo de una ligera traza. El elemento se obtuvo más tarde artificialmente con un acelerador, y sólo entonces los químicos pudieron disponer de material suficiente para realizar su detallado estudio. Por dicha razón, el francio, por lo general, es considerado uno de los elementos artificiales.
Fue de nuevo Segrè quien detectó el siguiente de los elementos que faltaban. Abandonó la Italia fascista, en 1938, y pasó a trabajar en el «Laboratorio de Radiación», de la Universidad de California. Con dos colegas de allí, D. R. Corson y K. R. Mackenzie, bombardeó bismuto con partículas alfa. Esta maniobra tuvo éxito al añadir a la partícula alfa dos protones del núcleo del bismuto, formando el elemento 85. Dado que el nuevo elemento carecía de elementos estables, se le denominó «astatinio», de una palabra griega que significa «inestable». Más tarde, se encontraron en la Naturaleza trazas de astatinio, como un producto de descomposición del uranio.
Así, pues, en 1940, tres de los cuatro últimos huecos habían quedado rellenados. El elemento que aún faltaba en la tabla de 92 elementos era el número 61. Y éste salió a luz de una manera enteramente distinta. No se produjo de una forma deliberada, sino como un resultado más del descubrimiento de la fisión nuclear.
Después que Chadwick encontrara el neutrón, en 1932, los físicos se percataron al instante de que constituía un precioso instrumento para la investigación de los núcleos atómicos y tal vez para formar nuevos elementos. Como partícula sin carga, no sería repelida por los núcleos cargados positivamente.
Uno de los primeros en empezar a bombardear núcleos con neutrones fue el gran físico italiano Enrico Fermi. A mediados de la década de 1930, Fermi y sus colegas de Roma llevaron a cabo muchos experimentos con neutrones. Entre otras cosas bombardearon uranio con partículas alfa, con la esperanza de crear elementos más allá del uranio. Creían que sucedería algo así al hacer esto, pero no pudieron demostrarlo. En realidad, consiguieron algunos productos que les desconcertaron a ellos y a los demás físicos durante varios años.
El resultado de este misterio constituye ahora una historia familiar: cómo Otto Hahn, en Alemania, descubrió que uno de estos productos era el bario, un elemento de sólo la mitad de peso que el uranio; cómo su antiguo compañero, Lise Meitner, que había escapado a Suecia huyendo de los nazis, llegó a convencerse de que el bombardeo del neutrón había escindido el átomo del uranio en dos («fisión del uranio»), y se apresuró a publicar su revolucionaria conclusión; cómo Fermi y otros físicos, muchos de ellos refugiados en Estados Unidos huyendo de las dictaduras europeas, llegaron al fin a producir una fisión de reacción en cadena y la bomba atómica.
El punto que nos interesa aquí es el de que la fisión del uranio produjo docenas de diferentes «productos de fisión», muchos de ellos nuevos isótopos que no habían sido conocidos anteriormente. Y, en 1948, tres químicos del «Oak Ridge National Laboratory» —J. A. Marinsky, L. E. Glendenin y C. D. Coryell— encontraron el elemento número 61 entre los productos de fisión. Tal y como los químicos habían sospechado, todos los isótopos del elemento demostraron ser radiactivos; el más longevo tenía una vida media de sólo 30 años. No era de extrañar que no hubiese sido encontrado en la Naturaleza…
Los descubridores llamaron a este elemento «promecio», por Prometeo dado que había sido creado en el cálido fuego del horno nuclear.
Y así quedó cubierto el último hueco de la tabla periódica. Pero el promecio no constituyó el final de la búsqueda de los elementos.
MÁS ALLÁ DEL 92
A fin de cuentas, el noventa y dos no era el límite. Fermi, que pensó que había construido el elemento número 93 y lo denominó «uranio X», no se había equivocado del todo. Su mezcla de productos del bombardeo del uranio incluía al elemento 93, aunque no pudo identificarlo.
En 1940, Edwin M. McMillan, de la Universidad de California, descubrió trazas de un elemento en los neutrones bombardeados del uranio, que pensó que debería tratarse del número 93. ¿Qué clase de elemento sería? En el séptimo período de la tabla periódica, el actinio (elemento 89) era conocido por ser químicamente similar al lantano. ¿Significaba esto que comenzaba una segunda serie de elementos de tierras raras, como las del lantano siguiente? Y si era así, el actinio, el torio, el protactinio, el uranio y el elemento 93 serían todos metales de tierras raras.
La química de estos elementos no era muy bien conocida en aquella época. La única cosa con la que los químicos debían proseguir, consistía en que alguna de las propiedades del uranio parecían asemejarse a las del tungsteno. Esto significaría que el uranio no era una tierra rara. Y si el uranio seguía a continuación del tungsteno en la tabla, entonces el elemento 93 sería parecido al renio, el elemento que seguía al tungsteno en el sexto período.
McMillan pidió a Segrè que analizase su muestra de «elemento 93». Segrè averiguó que no se parecía al renio, sino que era más bien una tierra rara.
McMillan y su ayudante, Philip Abelson, muy pronto estableció que su sustancia era definitivamente el elemento número 93. McMillan lo llamó «neptunio», por Neptuno, el planeta más allá de Urano, del que el uranio había recibido su nombre.
McMillan tuvo que abandonar su trabajo a causa de la guerra y dejó sus investigaciones a cargo de Glenn Theodore Seaborg, en California. Seaborg muy pronto descubrió que el neptunio radiactivo daba origen a otro elemento nuevo: el número 94. Cuando el neptunio se desintegraba, emitía un electrón de su núcleo, y uno de sus neutrones se cambiaba a protón. Esto elevó el número de protones de 93 a 94, por lo que se convirtió en un nuevo elemento. El elemento fue denominado «plutonio», por Plutón, el planeta situado más allá de Neptuno.
Tanto el neptunio como el plutonio se comportaban químicamente igual que las tierras raras, confirmando el que los elementos que comenzaban con el actinio deberían formar una segunda serie de tierras raras. Para distinguir a las dos series, el primer grupo (que comenzaba con el lantano) fue conocido como los «lantánidos», y el segundo grupo como los «actínidos».
El isótopo del neptunio de vida más larga, con un número másico de 237, tenía una vida media de un poco más de dos millones de años. Ya no quedaba ninguna traza detectable del neptunio originariamente presente en la tierra. Pero pequeñas cantidades del mismo debían de formarse, continuamente, a través de los neutrones de rayos cósmicos que incidían sobre el uranio en el suelo y en las rocas. Efectivamente, trazas de estos elementos han sido detectadas en las menas de uranio.
Si el neptunio y el plutonio podían fabricarse artificialmente, ¿por qué no producir más elementos transuránicos? Bajo la dirección de Seaborg, el grupo de California estableció un programa sistemático para ver cuán lejos podían llegar. Bombardearon cada elemento transuránico, sucesivamente, hasta formar otros con números atómicos superiores. El trabajo no resultaba sencillo, y se hacía más difícil de un elemento a otro. Las vidas medias de los sucesivos elementos eran cada vez más y más cortas, y, por tanto, resultaba cada vez más difícil recoger suficiente cantidad de cada elemento para poder fabricar el siguiente.
En 1944, Seaborg y dos de sus ayudantes, R. A. James y L. O. Morgan, tuvieron éxito en conseguir el elemento 95 al bombardear el uranio con partículas alfa. Dado que el 95 se parecía al europio en la primera serie de tierras raras, lo denominaron «americio», por América.
Más avanzado aquel año, Seaborg, James y A. Ghiorso rastrearon el elemento 96, esta vez bombardeando el plutonio con partículas alfa. Como colega del tierras raras gadolinio (llamado así por el cazador de elementos Gadolin), el número 96 fue denominado «curio», por los Curie.
En 1949, Seaborg, Ghiorso y S. G. Thompson anunciaron que, tras bombardear el americio con partículas alfa, habían formado el elemento 97. Al año siguiente, esos tres operarios y K. Street fabricaron el número 98 al bombardear el curio con partículas alfa. En honor del lugar en que estos elementos se estaban descubriendo, los números 97 y 98, respectivamente, fueron llamados «berquelio» (por Berkeley, la ciudad universitaria) y «californio».
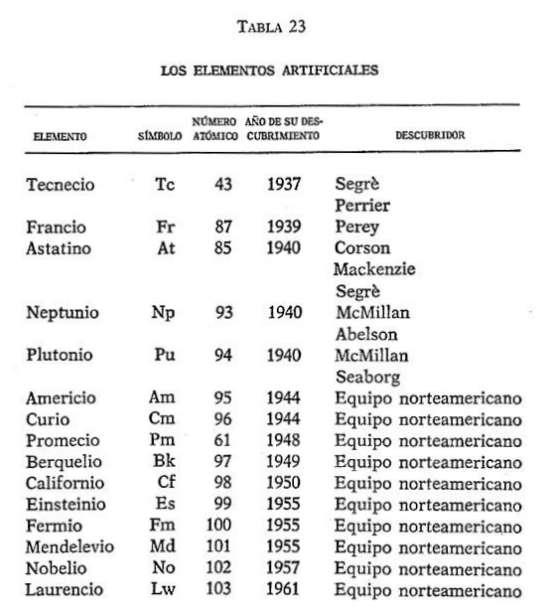
Los siguientes elementos aparecieron tras la terrorífica explosión de la primera bomba de hidrógeno, en 1952. En los restos de la explosión, los científicos detectaron trazas de lo que parecían ser los elementos 99 y 100. Dichos elementos fueron más tarde obtenidos en el laboratorio y anunciados en 1955.