13. LOS ELEMENTOS QUE FALTABAN
Al principio, los químicos se negaron a tomar en serio las predicciones de Mendéleiev. Ya se habían cometido demasiadas tonterías en nombre de la Química, pero nadie había intentado aún conjurar los elementos en alas de la pura imaginación. La gente había deducido los elementos de la muerte de ratones, por los colores de los minerales, por las líneas de un espectro. Pero Mendéleiev no tenía nada: sólo una tabla que había redactado y que daba la casualidad que aparecían en ella espacios en blanco. Sin embargo, presumía poder describir, con los detalles más nimios, unos elementos que no habían dado hasta entonces ninguna prueba tangible de su existencia.
Mendéleiev no prestó atención a los que se burlaban de él y se limitó a aguardar los acontecimientos. Y sucedió que no tuvo que esperar demasiado…
Un joven químico francés llamado Paul Émile Lecoq de Boisbaudran, que trabajaba en un pequeño laboratorio de su propiedad, quedó tan fascinado con el espectroscopio que, año tras año, no hizo otra cosa que estudiar detenidamente minerales con su instrumento. Un día, en 1874, detectó algunas raras líneas espectrales en un mineral que había recibido de unas minas de cinc de los. Pirineos. ¿Un nuevo elemento? Muy excitado, corrió a París para mostrar a los químicos importantes lo que había encontrado. Luego regresó a seguir trabajando en el aislamiento del elemento.
De centenares de kilos de mineral, al final consiguió unos montoncitos de un raro metal. Fundía a la baja temperatura de 30° C: incluso se fundía lentamente con el calor de la mano de una persona. Lecoq de Boisbaudran llamó al elemento «galio», del antiguo nombre latino de Francia. (Algunos creen que lo denominó así también por él mismo, dado que el apellido Lecoq significa «gallo», y la palabra latina correspondiente es gallus).
El químico francés se sintió regocijado con su descubrimiento, pero ni la mitad de excitado que Mendéleiev. Tan pronto como el ruso leyó la descripción del nuevo elemento, supo que era su ekaaluminio. Había predicho que el elemento fundiría a un punto bajo. Había estimado su peso atómico en unos 68 y el galio tenía 69,72. También había pronosticado que su peso específico sería de 5,9 y el galio tenía 5,94. Su comportamiento químico seguía sus predicciones. Punto por punto, el galio se adecuaba por completo al ekaaluminio.
Aquel notable adecuamiento causó sensación. Los químicos tuvieron que admitir que el galio era el ekaaluminio de Mendéleiev de forma absoluta. Tal como ahora aparecía, su tabla periódica no era sólo unos ingeniosos garabatos en un papel. Podía ser incluso una clave para la interpretación sistemática de los elementos y hasta de la Química en sí…
Constituyó tal vez el momento más excitante en toda la ya larga historia de la búsqueda de los elementos. Al fin, alguien había averiguado lo suficiente sobre los elementos, como para predecir la existencia de uno que nadie había sospechado nunca.
Cuatro años después, se cumplió la segunda profecía de Mendéleiev. Lars Fredrick Nilson, un químico sueco, estaba estudiando un mineral recientemente descubierto. De manera por completo accidental, se vio ante un óxido que no le era familiar. Decidió que era el óxido de un nuevo elemento, y lo llamó «escandio», en honor de Escandinavia, donde el mineral había sido encontrado.
Fue otro cazaelementos sueco, Per Teodor Cleve, quien se percató de que el escandio se parecía a uno de los elementos perdidos de Mendéleiev. Se comportaba tal y como Mendéleiev había predicho que le sucedería al ekaboro. De nuevo, la descripción de Mendéleiev del elemento demostró ser casi del todo correcta en cada detalle. El peso atómico del escandio era de 44,96 (la predicción había sido 44); el óxido dé escandio tenía un peso específico de 3,86 (previsión: 3,5), etc.
El triunfo final de Mendéleiev llegó en 1886. Un químico alemán, Clemens Alexander Winkler, se encontraba analizando un mineral de una mina de plata y se le presentaron algunos problemas. Después de descomponer todos los elementos que pudo identificar, halló que aún le quedaba un 70 por ciento de otro mineral. Winkler decidió que éste debía de constituir un elemento desconocido. Trabajó en él durante meses y, al final, logró extraer el elemento. Lo llamó «germanio», por Alemania[3].
Ahora los químicos debían echar una ojeada al tercer elemento de Mendéleiev. El germanio, según averiguó rápidamente Winkler, era sin duda este tercer elemento perdido, el ekasilicio. Su peso atómico era de 72,60 (casi exactamente los previstos 72); su peso específico era de 5,47 (la prevista: 5,5). Tal y como Mendéleiev había dicho, el elemento formaba un tetracloruro de bajo punto de ebullición. Mendéleiev sólo se había equivocado en un cálculo; el germanio fundía a una temperatura menor de la que había vaticinado.
Mendéleiev había triunfado las tres veces… Su tabla periódica fue ahora reconocida como un descubrimiento monumental…
Los dirigentes de Rusia se apresuraron a conceder honores a su prestigioso científico. Lo enviaron en una misión a Estados Unidos (otro país muy subestimado en aquel tiempo por los europeos occidentales) para estudiar los yacimientos petrolíferos de Pensilvania, a fin de tener una guía de cómo debían desarrollarse los campos petrolíferos del Cáucaso.
Mientras, las más aristocráticas sociedades científicas de Europa también honraban a Mendéleiev. La Royal Society, de Londres, le recompensó con la codiciada «Medalla Davy», en 1882. Le siguieron otras medallas y distinciones.
Mendéleiev fue también un auténtico pionero en otros campos, además de la Química. En 1887, subió en globo para fotografiar un eclipse solar. Hay una fotografía en la que se le ve erguido en la góndola con una gran dignidad, con el aspecto de un patriarca bíblico, con sus flotantes cabellos y su larga barba. Mendéleiev también habló con arrojo contra el Gobierno zarista, en defensa de los estudiantes descontentos. Al igual que otros muchos intelectuales rusos, quedó conmocionado y desilusionado por la derrota de Rusia ante el Japón, en la guerra de 1904, pero no vivió lo suficiente para presenciar la inevitable revolución contra el régimen de los zares.
El triunfo de la tabla periódica de Mendéleiev también aportó reconocimiento y vindicación para Meyer, Newlands e incluso para Béguyer de Chancourtois. En efecto, en 1891, una publicación científica francesa, tardíamente, imprimió el diagrama del más perfeccionado «tornillo telúrico».
LOS ELEMENTOS SIN PREDECIR
Ahora se presentaba la tarea de acabar de rellenar la tabla. El esquema de Mendéleiev sugería que existía un número limitado de elementos. Todo cuanto los químicos tenían que hacer era completar sus hileras y períodos y verificar la existencia de aquellos elementos que aún no habían sido aislados. Por lo menos, esto era lo que parecía…
El flúor era un elemento que se había resistido tozudamente a ser aislado. Los químicos sabían dónde encontrarlo, pero no les acompañaba la suerte a la hora de separarlo de sus compuestos. En 1886, tras heroicos esfuerzos, un químico francés, llamado Henri Moissan, finalmente logró atraparlo.
El flúor había desafiado a su liberación, debido a que era extremadamente activo. Atacaba al agua, a la mayor parte de los metales, e incluso al vidrio, por lo que el equipo de laboratorio tuvo que ser sumergido en agua en cuanto quedó liberado. Además, también atacaba a los tejidos vivos, y Moissan resultó gravemente intoxicado varias veces durante sus experimentos.
Al fin, consiguió hallar la estrategia adecuada. Como contenedores para albergar el gas empleó una aleación de platino y de iridio, el más inerte de los metales conocidos. Para enlentecer la actividad del flúor, enfrió su equipo a la menor temperatura que le fue posible conseguir. Con esas técnicas logró, por lo menos, atrapar un poco de flúor libre dentro de sus recipientes de metal noble. En 1906, el año anterior a su muerte, recibió el premio Nobel de Química por sus logros.
(Moissan consiguió otra clase de fama al anunciar que había logrado fabricar diamantes artificiales partiendo del carbono, al disolverse en hierro fundido. Mostró algunos pedazos de diamante para apoyar su alegación. Pero ahora sabemos que su método no podía dar resultado. Existe la teoría de que un ayudante deslizó algunos fragmentos de diamante en las preparaciones del profesor, como una broma práctica).
Después del descubrimiento del galio, del escandio y del germanio, aún quedaban tres huecos en la tabla de Mendéleiev: uno en el quinto período y dos en el sexto. Nadie dudó de que, eventualmente, se llenarían a través de nuevos descubrimientos. Pero a todos los había intrigado un molesto detalle. Existían varios elementos conocidos para los que no se había encontrado espacio en la tabla…
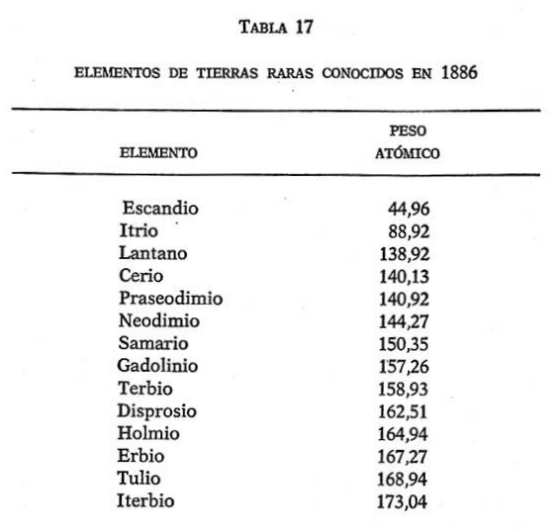
El problema comenzó con tres elementos de tierras raras: cerio, erbio y terbio. La tabla de Mendéleiev no tenía un lugar apropiado para ellos y se vio obligado a meterlos juntos de cualquier manera. (Hemos retirado esos elementos de la tabla 16 para evitar problemas).
Esas patitas de mosca en un cuadro, por otra parte, tan perfecto, habían sido pasados por alto, pero cuanto más tiempo transcurría, más embarazosos resultaban. La lista de nuevos elementos que no encajaban en la tabla continuaba creciendo…
En 1879, Lecoq de Boisbaudran, aún al pie de su espectroscopio, descubrió unas nuevas líneas espectrales en un mineral ruso de tierras raras llamado samarsquita. Las adscribió a un nuevo elemento al que denominó «samario». Mientras tanto, Cleve (el químico que había reconocido al escandio como el ekaboro de Mendéleiev), localizó otros dos elementos de tierras raras con el espectroscopio. A una la llamó «holmio», por Estocolmo, y a la segunda «tulio», por Tule, el antiguo nombre latino de las tierras del lejano Norte. En lo que se refiere al descubrimiento del holmio, un físico francés, llamado Louis Soret, comparte la fama con Cleve, porque también observó aquellas líneas del espectro casi al mismo tiempo.
Los elementos tierras raras siguieron multiplicándose como malas hierbas. Lecoq de Boisbaudran encontró, en la misma mena con holmio, otro elemento al que llamó «disprosio», de la palabra griega dysprositos, de «difícil acceso». Un químico suizo, Jean-Charles Galissard de Marignac, encontró un nuevo elemento al que llamó «iterbio», el cuarto en ser denominado así según el pueblo de Ytterby. Aún consiguió descubrir otro en la mena de holmio; Lecoq de Boisbaudran, que también lo localizó, sugirió que se llamase «gadolinio» en honor de Johan Gadolin, el descubridor del primer elemento de las tierras raras. Y un químico austríaco, Cari Auer Welsbach, desentrañó dos elementos casi idénticos, a los, que llamó «praseodomio» («gemelo verde») y «neodimio» («nuevo gemelo»).
Así, pues, aquí había ocho elementos más que debían añadirse a la tabla periódica. ¿Y cómo encajarlos? En ninguna parte, por lo que todos podían ver. Junto con el cerio, el erbio y el terbio, formaban un total de once elementos sin hogar, para los que no existían lugares apropiados.
Lógicamente, los once pertenecían a la hilera IIIa, junto con los demás elementos conocidos de tierras raras. Todos los elementos de tierras raras eran muy parecidos, poseían una valencia de 3 y parecían encontrarse siempre juntos. Pero los compartimientos de la hilera Illa estaban ya ocupados con el escandio, el itrio y el lantano (véase tabla 16). Y los once elementos sin hogar venían, exactamente, detrás del lantano en peso atómico, tal y como muestra la tabla 17. Esto significaba que debían colocarse en el sexto período. El único lugar en que encajarían en ese período, de acuerdo con sus propiedades químicas, era en el mismo cajón, con el tierras raras del lantano. En resumen, para conseguir que la tabla funcionase, 12 elementos debían amontonarse en el mismo compartimiento. La tabla tan nítida de Mendéleiev se estaba convirtiendo en algo no tan claro.
Se iban a presentar más complicaciones, como nos proponemos exponer.
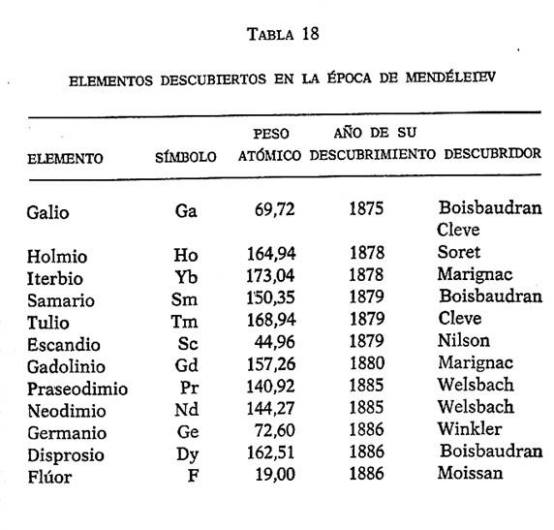
Para poner al día nuestra crónica del descubrimiento de los elementos, relacionamos en la tabla 18 los elementos descubiertos en los años que siguieron a la publicación de la tabla de Mendéleiev. La lista de los elementos había aumentado hasta setenta y cuatro.
LA HILERA IMPREVISTA
A fines del siglo XIX, otro hecho asombroso conmocionó a los químicos. No hacían más que sacar a luz una nueva serie de elementos que no encontraban sitio en la tabla de Mendéleiev. Pero esta vez la solución era sencilla. Simplemente, Mendéleiev se había olvidado una hilera completa…
Realmente, la historia comienza con el intrigante hecho que Henry Cavendish ya había descubierto antes. Había tratado de averiguar si existían otros gases en el aire, además del oxígeno y el nitrógeno. El retirar el oxígeno de su muestra de aire no constituía ningún problema; consiguió desembarazarse con facilidad de él. El nitrógeno era una cosa más difícil, porque se negaba a formar compuestos para ser eliminado. Pero Cavendish, finalmente, consiguió forzarlo en combinaciones con algún tipo de producto químico muy activo. Al fin, se quedó con el 1 % de aire original y que no podía combinarse con nada. Decidió que este gas que quedaba no podía ser nitrógeno. Debería ser incluso más inerte que el nitrógeno. Pero no existía modo de identificar el gas, y los otros químicos ignoraron la conjetura de Cavendish de que se trataba de un nuevo elemento.
En la década de 1890, Robert John Strutt, el famoso físico más conocido como Lord Rayleigh, reavivó la cuestión. Descubrió que el «nitrógeno» del aire pesaba ligeramente más que las muestras de nitrógeno de los minerales que contenían nitrógeno. ¿Significaba esto, quizá, que algún gas desconocido y más pesado, se encontraba mezclado con el nitrógeno que había obtenido del aire? Lord Rayleigh puso a un ayudante, un químico escocés llamado William Ramsay, a trabajar en este problema.
Ramsay repitió el experimento de Cavendish, y de una manera parecida llegó al final a un burbujeo de un gas completo inerte.
Pero ahora contaba con el espectroscopio, instrumento del que Cavendish había carecido, para examinar este gas. Lo calentó hasta que brilló, y su espectro mostró unas nuevas líneas. En efecto, se trataba de un nuevo elemento. Ramsay lo llamó «argón», del griego argos, inactivo.
¿Dónde debía situarse el argón en la tabla periódica? Su peso atómico, 39,944, quedaba entre los del potasio y el calcio, pero no había ningún puesto vacante entre ellos. La solución de Ramsay fue situar el argón por delante del potasio, a pesar de su levemente mayor peso atómico, porque de esta manera podía colocar al nuevo elemento al final de la columna precedente y añadir una nueva hilera.
Debemos recordar que Mendéleiev había confeccionado su tabla basándose en las valencias. ¿Y cuál era la valencia del argón? Pues la valencia de un elemento completamente inerte podía considerarse igual a cero. Esto encajaría muy bien con el esquema de Mendéleiev, puesto que la valencia de los elementos, inmediatamente antes e inmediatamente después del argón, era de 1. Si el cero se colocaba entre estos unos, y se crease un nuevo escalón en cada período, todos los períodos seguirían estando bien, dado que una nueva hilera había sido añadida al final de la tabla.
Ramsay hizo sitio para añadir la hilera: la llamó «hilera O». El argón fue incluido en la hilera O en la parte inferior del tercer período, debajo del cloro. Naturalmente, aquello levantó de nuevo la veda en la caza de los elementos. ¿Qué otros elementos deberían situarse en la nueva hilera?
Ramsay comenzó por buscarlos en el aire, razonando que, probablemente, contenía trazas de otros gases inertes además del argón. Su intuición resultó correcta. Con un colaborador, Morris William Travers, pronto rastreó el «neón» (al que llamó así derivado de la palabra griega neos, que significa «nuevo»), «criptón» (que significaba «oculto») y xenón (con significado de «extraño»). Los tres eran gases inertes, como el argón. El neón ocupaba muy bien su lugar debajo del flúor y al final del segundo período, el criptón debajo del bromo, en el cuarto período, y el xenón debajo del yodo, en el quinto período.
Mientras tanto, Ramsay había tenido suerte con otro gas inerte en una zona por completo inesperada. Un químico norteamericano, William Francés Hillebrand, había descubierto en un mineral que contenía uranio, un gas del que pensó que se trataba de nitrógeno. Ramsay, que seguía la exploración hacia los nuevos gases, decidió examinarlo posteriormente. Él también halló el gas inerte en un mineral que contenía uranio, y lo observó con el espectroscopio… ¡Eureka…! Mostraba unas líneas que no pertenecían al nitrógeno. Y lo que resultaba más sorprendente era que se trataba de las mismas líneas que habían sido descubiertas en el Sol, hacía casi treinta años, y que se atribuyeron a un elemento solar al que llamó helio el astrónomo inglés Lockyer (véase capítulo 10).
Lockyer no tenía la menor idea de qué clase de elemento debería ser, por lo que le había dado la terminación común «io», que, por acuerdo, se aplica a los metales. Si hubiese sospechado que se trataba de un gas, seguramente le habría denominado «helión».
El helio, el elemento más ligero después, del hidrógeno, naturalmente, ocupó su sitio al final del primer período. Ramsay había llenado ya los lugares en la nueva hilera desde la primera a la quinta columnas. Por su descubrimiento de los gases «nobles», recibió el premio Nobel de Química, en 1904.
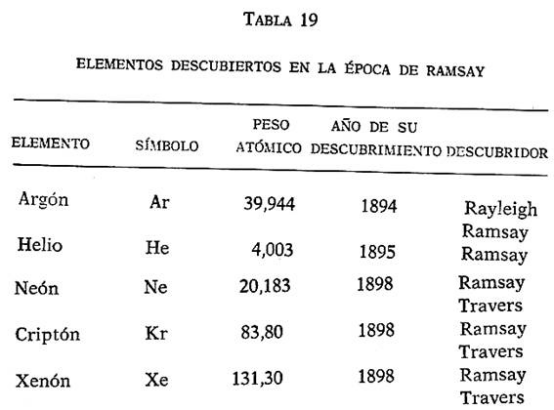
Estos elementos, con sus pesos, atómicos, se relacionan en la tabla 19. Elevaron el número total de los elementos conocidos hasta 79.
La tabla periódica había resistido, prácticamente, toda clase de pruebas. Su esquema general estaba tan bien establecido, que la adición de una nueva hilera no lo había estropeado en absoluto; en realidad, aún lo había reforzado. Pero existía aún el espinoso problema de la bolsa repleta con los elementos de tierras raras, que se aglomeraban con el lantano. ¿Y qué cabía decir del final de la tabla, de más allá del sexto período? ¿Cuántos elementos más se encontrarían allí? ¿Y qué longitud acabaría teniendo la tabla?