La materia está hecha de átomos
Si, por algún cataclismo, todo el conocimiento quedara destruido y sólo una sentencia pasara a las siguientes generaciones de criaturas, ¿qué enunciado contendría la máxima información en menos palabras? Yo creo que es la hipótesis atómica (o el hecho atómico, o como quiera que ustedes deseen llamarlo) según la cual todas las cosas están hechas de átomos: pequeñas partículas que se mueven en movimiento perpetuo, atrayéndose mutuamente cuando están a poca distancia, pero repeliéndose al ser apretadas unas contra otras. Verán ustedes que en esa simple sentencia hay una enorme cantidad de información acerca del mundo, con tal de que se aplique un poco de imaginación y reflexión.

1.1 Agua ampliada mil millones de veces.
Para ilustrar la potencia de la idea atómica, supongamos que tenemos una gota de agua de 5 milímetros de diámetro. Si la miramos muy de cerca no vemos otra cosa que agua: agua uniforme y continua. Si la ampliamos con el mejor microscopio óptico disponible —aproximadamente dos mil veces— la gota de agua tendrá aproximadamente 10 metros de diámetro, el tamaño aproximado de una habitación grande, y si ahora la miráramos desde muy cerca, aún veríamos agua relativamente uniforme, pero aquí y allí nadan de un lado a otro pequeñas cosas con forma de un balón de rugby. Muy interesante. Son paramecios. Quizá ustedes se queden en este punto y sientan tanta curiosidad por los paramecios con sus cilios cimbreantes y cuerpos contorsionados que ya no sigan más adelante, excepto quizá para ampliar aún más los paramecios y ver qué hay en su interior. Esto, por supuesto, es un tema para la biología, pero por el momento continuaremos y miraremos aún más de cerca al propio material acuoso, ampliándolo dos mil veces más. Ahora la gota de agua se extiende hasta 20 kilómetros de diámetro, y si la miramos muy de cerca vemos una especie de hormigueo, algo que ya no tiene una apariencia lisa; se parece a una multitud en un partido de futbol vista a gran distancia. Para ver qué es este hormigueo, lo ampliaremos otras doscientas cincuenta veces y veremos algo similar a lo que se muestra en la figura 1.1. Esta es una imagen del agua ampliada mil millones de veces, pero idealizada en varios sentidos. En primer lugar, las partículas están dibujadas de una forma muy simple con bordes definidos, lo que no es exacto. En segundo lugar, y por simplicidad, están esbozadas casi esquemáticamente en una formación bidimensional, pero por supuesto se mueven en tres dimensiones. Nótese que hay dos tipos de «manchas» o círculos que representan los átomos de oxígeno (negros) e hidrógeno (blancos), y que a cada oxígeno hay unidos dos hidrógenos. (Cada grupo pequeño de un oxígeno con sus dos hidrógenos se denomina una molécula). La imagen aún está más idealizada por el hecho de que las partículas reales en la naturaleza están agitándose y rebotando continuamente, girando y moviéndose unas alrededor de las otras. Ustedes tendrán que imaginarse esto como una imagen dinámica más que estática. Otra cosa que no puede ilustrarse en un dibujo es el hecho de que las partículas están «adheridas»: que se atraen entre sí, ésta atraída por esa otra, etc. El grupo entero está «pegado», por así decir. Por otra parte, las partículas no se interpenetran. Si ustedes tratan de comprimir dos de ellas y juntarlas demasiado, ellas se repelen.
Los átomos tienen 1 o 2 × 10−8 cm de radio. Ahora bien, 10−8 cm se denomina un ångström (tan sólo otro nombre), de modo que decimos que tienen 1 o 2 ångströms (Å) de radio. Otra manera de recordar este tamaño es la siguiente: si se ampliara una manzana hasta el tamaño de la Tierra, entonces los átomos de la manzana tendrían aproximadamente el tamaño de la manzana original.
Imaginemos ahora esta gran gota de agua con todas estas partículas zigzagueantes adheridas y siguiéndose unas a otras. El agua mantiene su volumen; no se deshace, porque hay una atracción mutua entre las moléculas. Si la gota está en una pendiente, donde puede moverse de un lugar a otro, el agua fluirá, pero no desaparece simplemente —las cosas no se desvanecen— porque existe una atracción molecular. Este movimiento de agitación es lo que representamos como calor: cuando aumentamos la temperatura, aumentamos el movimiento. Si calentamos el agua, la agitación aumenta y aumenta el volumen entre los átomos, y si el calentamiento continúa llega un momento en que la atracción entre las moléculas no es suficiente para mantenerlas juntas y se disgregan separándose unas de otras. Por supuesto, así es como producimos vapor a partir del agua: aumentando la temperatura; las partículas se separan debido al incremento del movimiento.
En la figura 1.2 tenemos una imagen del vapor. Esta imagen del vapor falla en un aspecto: a la presión atmosférica ordinaria podría haber tan sólo unas pocas moléculas en toda una habitación, y difícilmente llegaría a haber tres en una figura como esta. La mayoría de los cuadrados de este tamaño no contendrían ninguna, pero nosotros tenemos accidentalmente dos y media o tres en la imagen (sólo para que no estuviera completamente vacía). Ahora bien, en el caso del vapor vemos las moléculas características de forma más clara que en el agua. Por simplicidad, las moléculas se han dibujado de modo que haya un ángulo de 120° entre los átomos de hidrógeno. En realidad el ángulo es de 105° 3’, y la distancia entre el centro de un hidrógeno y el centro del oxígeno es de 0,957Å, de modo que conocemos muy bien esta molécula.
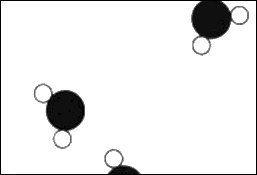
1.2 Vapor de agua.
Veamos cuáles son algunas de las propiedades del vapor de agua o cualquier otro gas. Las moléculas, estando separadas unas de otras, rebotarán contra las paredes. Imaginemos una habitación con varias pelotas de tenis (un centenar más o menos) rebotando en movimiento perpetuo. Cuando bombardean la pared se produce un empuje sobre la misma. (Por supuesto, nosotros tendríamos que empujar la pared desde atrás para mantenerla fija). Esto significa que el gas ejerce una fuerza agitatoria que nuestros torpes sentidos (al no estar nosotros mismos ampliados mil millones de veces) sienten sólo como un empuje promedio. Para confinar un gas debemos aplicar una presión.

1.3 Recipiente estándar para mantener gases.
La figura 1.3 muestra un recipiente estándar para mantener gases (utilizado en todos los libros de texto), un cilindro provisto de un pistón. Ahora bien, no hay ninguna diferencia en cuáles sean las formas de las moléculas de agua, de modo que por simplicidad las dibujaremos como pelotas de tenis o puntos pequeños. Estas cosas están en movimiento perpetuo en todas direcciones. Tantas están golpeando el pistón superior continuamente que para evitar que se salgan del tanque por este golpeteo tendremos que sujetar el pistón mediante una cierta fuerza que llamamos presión (en realidad, la fuerza es la presión multiplicada por el área). Evidentemente, la fuerza es proporcional al área, pues si aumentamos el área pero mantenemos constante el número de moléculas por centímetro cúbico, aumentamos el número de colisiones con el pistón en la misma proporción en que aumenta el área.
Pongamos ahora el doble de moléculas en este tanque, de modo que se duplique la densidad, y hagamos que tengan la misma velocidad, es decir, la misma temperatura. Entonces, en una buena aproximación, el número de colisiones se duplicará y, puesto que cada una de ellas será igual de «energética» que antes, la presión será proporcional a la densidad. Si consideramos la verdadera naturaleza de las fuerzas entre los átomos, cabría esperar una ligera disminución en la presión debida a la atracción entre los mismos, y un ligero incremento debido al volumen finito que ocupan. De todas formas, con una aproximación excelente, si la densidad es lo suficientemente baja para que no haya muchos átomos, la presión es proporcional a la densidad.
También podemos ver algo más: si aumentamos la temperatura sin cambiar la densidad del gas, o sea, si aumentamos la velocidad de los átomos, ¿qué sucederá con la presión? Bien, los átomos golpean con más fuerza porque se están moviendo con más rapidez, y además golpean con más frecuencia, de modo que la presión aumenta. Vean ustedes qué simples son las ideas de la teoría atómica.
Consideremos otra situación. Supongamos que el pistón se mueve hacia adentro, de modo que los átomos son lentamente comprimidos en un espacio menor. ¿Qué sucede cuando un átomo golpea contra el pistón en movimiento? Evidentemente gana velocidad en la colisión. Ustedes pueden intentarlo haciendo rebotar una pelota de ping-pong en una pala que se mueve hacia ella, por ejemplo, y encontrarán que sale rebotada con más velocidad con la que chocó. (Ejemplo especial: si resulta que un átomo está en reposo y el pistón le golpea, el átomo ciertamente se moverá). Así pues, los átomos están «más calientes» cuando vuelven del pistón que antes de que chocasen en él. Por consiguiente, todos los átomos que están en el recipiente habrán ganado velocidad. Esto significa que cuando comprimimos lentamente un gas, la temperatura del gas aumenta. De este modo, en una compresión lenta, un gas aumentará su temperatura, y en una expansión lenta disminuirá su temperatura.
Volvamos ahora a nuestra gota de agua y consideremos otro aspecto. Supongamos que disminuimos la temperatura de nuestra gota de agua. Supongamos que la agitación de las moléculas de los átomos del agua está decreciendo continuamente. Sabemos que existen fuerzas atractivas entre los átomos, de modo que al cabo de algún tiempo ya no serán capaces de agitarse tanto. Lo que sucederá a temperaturas muy bajas está indicado en la figura 1.4: las moléculas se quedarán bloqueadas en una nueva estructura, el hielo. Este diagrama esquemático concreto del hielo no es muy bueno porque está en dos dimensiones, pero es cualitativamente correcto. El punto interesante es que en el material hay un lugar definido para cada átomo, y ustedes pueden apreciar fácilmente que si de un modo u otro mantuviéramos todos los átomos de un extremo de la gota en una cierta disposición, cada uno de ellos en un determinado lugar, entonces, debido a la estructura de las interconexiones, que es rígida, el otro extremo a kilómetros de distancia (en nuestra escala ampliada) tendría una posición definida. Así, si agarramos una aguja de hielo por un extremo, el otro extremo aguanta nuestra fuerza, a diferencia del caso del agua en el que la estructura se desmorona debido a la agitación creciente que hace que todos los átomos se muevan de formas diferentes. La diferencia entre sólidos y líquidos consiste entonces en que en un sólido los átomos están dispuestos en algún tipo de formación, llamada una red cristalina, y no tienen una posición aleatoria a grandes distancias; la posición de los átomos en un extremo del cristal está determinada por la de otros a millones de átomos de distancia al otro extremo del cristal. La figura 1.4 es una disposición imaginaria para el hielo pero, aunque contiene muchas de las características correctas del hielo, no es la disposición verdadera. Una de las características correctas es que hay una parte de la simetría que es hexagonal. Ustedes pueden ver que, si giramos la figura 120° alrededor de un eje, la imagen vuelve a ser la misma. Así pues, hay una simetría en el hielo que explica por qué los copos de nieve aparecen con seis lados. Otra cosa que podemos ver de la figura 1.4 es por qué el hielo se contrae cuando se funde. La estructura cristalina concreta del hielo mostrada aquí tiene muchos «agujeros» en su interior, como los tiene la verdadera estructura del hielo. Cuando la organización se desmorona, estos agujeros pueden ser ocupados por moléculas. La mayoría de las sustancias simples, con la excepción del agua y algún metal, se expanden al fundirse, porque los átomos están empaquetados más estrechamente en el sólido cristalino y al fundirse necesitan más sitio para agitarse; pero una estructura abierta colapsa, como es el caso del agua.

1.4 Hielo.
Ahora bien, aunque el hielo tiene una forma cristalina «rígida», su temperatura puede cambiar: el hielo tiene calor. Si queremos, podemos cambiar la cantidad de calor. ¿Qué es el calor en el caso del hielo? Los átomos no están en reposo. Están agitándose y vibrando. Así pues, incluso si hay un orden definido en el cristal —una estructura definida—, todos los átomos están vibrando «en su sitio». A medida que aumentamos la temperatura, vibran con una amplitud cada vez mayor, hasta que se salen de su sitio. Llamamos a esto fusión. A medida que disminuimos la temperatura, la vibración disminuye cada vez más hasta que, en el cero absoluto, se reduce a una cantidad mínima de vibración que pueden tener los átomos, aunque no nula. Esta cantidad de movimiento mínima que pueden tener los átomos no es suficiente para fundir una sustancia, con una excepción: el helio. El helio simplemente reduce los movimientos atómicos tanto como puede, pero incluso en el cero absoluto hay todavía movimiento suficiente para evitar la congelación. El helio no se congela ni siquiera en el cero absoluto, a menos que la presión sea tan grande como para hacer que los átomos se aplasten unos contra otros. Si aumentamos la presión, podemos hacer que se solidifique.