5. Los átomos
La ley de Proust
Los éxitos de Lavoisier estimularon a los químicos a buscar y explorar otras áreas en las que las mediciones precisas pudieran iluminar el estudio de las reacciones químicas. Los ácidos constituían una de estas áreas.
Los ácidos forman un grupo natural que comparten un cierto número de propiedades. Son químicamente activos, reaccionando con metales tales como el cinc, estaño o hierro, disolviéndolos y produciendo hidrógeno. Tienen sabor agrio (si se diluyen o rebajan lo suficiente como para probarlos con impunidad), provocan manchas y cambian los colores de un modo determinado, etc.
Opuesto a los ácidos hay otro grupo de sustancias llamadas bases. (Las bases fuertes se llaman álcalis). Son también químicamente activas, de sabor amargo, cambian el tono de los colores de modo opuesto al inducido por los ácidos, etc. En particular, las soluciones de ácidos pueden neutralizar soluciones de bases. En otras palabras, si los ácidos y las bases se mezclan en proporciones convenientes, la mezcla muestra unas propiedades que no son ni de ácido ni de base. La mezcla será una solución de sal, que, en general, es un compuesto mucho más ligero que un ácido o una base. Así, si una solución de ácido clorhídrico, fuerte y cáustico, se mezcla con la cantidad conveniente de hidróxido sódico, álcali fuerte y cáustico, se transformará en una solución de cloruro sódico, sal común de cocina.
El químico alemán Jeremias Benjamin Richter (1762-1807) dirigió su atención hacia estas reacciones de neutralización y midió la cantidad exacta de los diferentes ácidos que se precisaban para neutralizar una cantidad determinada de una base particular, y viceversa. Por medio de mediciones cuidadosas halló que se necesitaban cantidades fijas y definidas. No existía el margen con que un cocinero puede contar en la cocina, donde un poco de más o de menos en algunos ingredientes no es demasiado importante. En lugar de ello había algo así como un peso equivalente: un peso fijo de un compuesto reaccionaba con un peso fijo de otro. Richter publicó su trabajo en 1792.
Dos químicos franceses estaban empeñados en una enconada batalla para ver si esta suerte de exactitud existía no solamente en la neutralización ácido-base, sino a través de toda la química. Dicho brevemente: si un compuesto determinado estaba formado de dos elementos (o tres, o cuatro), ¿están esos elementos siempre presentes en este compuesto en las mismas proporciones fijas o pueden variar estas proporciones según el método de preparación del compuesto? Berthollet, uno de los que colaboraron con Lavoisier en el establecimiento de la moderna terminología química (véase pág. 73), pensaba lo último. De acuerdo con el punto de vista de Berthollet, un compuesto formado por los elementos x e y podía contener una cantidad de x mayor si se preparaba utilizando un gran exceso de x.
Opuesta a los puntos de vista de Berthollet estaba la opinión de Joseph Louis Proust (1754-1826), quien hizo su trabajo en España, a salvo (durante algún tiempo) de las convulsiones de la Revolución Francesa. Utilizando análisis cuidadosos y concienzudos, Proust demostró en 1799 que el carbonato de cobre, por ejemplo, contenía cobre, carbono y oxígeno en proporciones definidas en peso, no importando cómo se hubiera preparado en el laboratorio ni cómo se hubiera aislado de las fuentes naturales. La proporción era siempre de 5,3 partes de cobre por 4 de oxígeno y 1 de carbono.
Proust llegó a demostrar que una situación similar prevalecía también para muchos otros compuestos, y formuló la generalización de que todos los compuestos contenían elementos en ciertas proporciones definidas y no en otras combinaciones, independientemente de las condiciones bajo las que se hubiesen formado. Esto se llamó la ley de las proporciones definidas o, a veces, ley de Proust. (Proust también demostró que Berthollet, al presentar la evidencia de que ciertos compuestos variaban en su composición de acuerdo con el método de preparación, se equivocó por culpa de los análisis poco precisos y por el uso de productos que habían sido purificados insuficientemente).
Durante los primeros años del siglo XIX quedó bastante claro que Proust estaba en lo cierto. Otros químicos verificaron la ley de las proporciones definidas, y ésta se convirtió en la piedra angular de la química[11].
A partir del momento en que se dio a conocer la ley de Proust empezaron a plantearse dentro del panorama de la química una serie de problemas muy importantes.
Después de todo, ¿por qué había de ser cierta la ley de las proporciones definidas? ¿Por qué un cierto compuesto tenía que estar hecho siempre de 4 partes de x y 1 parte de y, pongamos por caso, y nunca de 4,1 partes de x o 3,9 partes de x por 1 parte de y? Si la materia fuese continua, sería difícil de entender esto. ¿Por qué no podrían los elementos mezclarse en proporciones ligeramente variables?
Por el contrario, ¿qué ocurriría si la materia fuese de naturaleza atómica? Supongamos que un compuesto se forma cuando un átomo de x se une con un átomo de y y no de otra manera. (Tal combinación de átomos acabaría por llamarse molécula, de la palabra latina que significa «pequeña masa»). Supongamos, a continuación, que cada átomo de x pesase 4 veces más que cada átomo de y. Entonces, el compuesto tendría que tener exactamente 4 partes de x y 1 parte de y.
Para variar tales proporciones sería necesario que un átomo de y estuviese unido a un poco más o un poco menos que un átomo de x. Toda vez que un átomo, ya desde el tiempo de Demócrito, se había considerado como una parte de materia indivisible, no era razonable esperar que una pequeña parte pudiera abandonar un átomo, o que una fracción de un segundo átomo pudiera añadirse a él.
En otras palabras, si la materia estaba formada de átomos, entonces la ley de las proporciones definidas se deducía como una consecuencia natural. Por otra parte, a partir del hecho de que la ley de las proposiciones definidas fue observada efectivamente, puede deducirse que los átomos son verdaderamente objetos indivisibles.
La teoría de Dalton
El químico inglés John Dalton (1766-1844) consideró detenidamente esta cadena de razonamientos, ayudado por un descubrimiento propio. Dos elementos, averiguó, pueden combinarse, después de todo, en más de una proporción, en cuyo caso exhiben una gran variación de proporciones de combinación y en cada variación se forma un compuesto diferente (ver fig. 9).

Fig. 9. Símbolos de Dalton para algunos de los elementos y compuestos. Entre ellos, hidrógeno (1); carbono (3); oxígeno (4); cobre (15); plata (17); oro (19); agua (21). Se equivocó con el agua, describiéndola como HO en lugar de H20, pero sus fórmulas para el monóxido de carbono (25) y dióxido de carbono (28) eran correctas.
Como ejemplo sencillo consideremos los elementos carbono y oxígeno. Las mediciones muestran que tres partes de carbono (en peso) combinarán con ocho partes de oxígeno para formar dióxido de carbono. Sin embargo, tres partes de carbono y cuatro partes de oxígeno producen monóxido de carbono. En tal caso se comprueba que las diferentes cantidades de oxígeno que se combinan con una cantidad fija de carbono están relacionadas en la forma de números enteros sencillos. Las ocho partes presentes en el dióxido de carbono son exactamente el doble que las cuatro partes presentes en el monóxido de carbono.
Esta es la ley de las proporciones múltiples. Dalton, después de observar su existencia en una cierta cantidad de reacciones, la publicó en 1803.
La ley de las proporciones múltiples encaja limpiamente con las nociones atomistas. Supongamos, por ejemplo, que el peso de los átomos de oxígeno sea siempre 1-1/3 veces el peso de los átomos de carbono. Si el monóxido de carbono se forma a través de la combinación de un átomo de carbono con un átomo de oxígeno, el compuesto debe constar de tres partes en peso de carbono y cuatro partes de oxígeno.
Entonces, si el dióxido de carbono está formado de un átomo de carbono y dos átomos de oxígeno, la proporción debe ser naturalmente de tres partes de carbono por ocho de oxígeno.
Las relaciones en forma de múltiplos sencillos reflejarían la existencia de compuestos cuya constitución difiere en átomos completos. Indudablemente, si la materia consistiese en pequeños átomos indivisibles, éstas serían precisamente las variaciones en su constitución que esperaríamos encontrar, y la ley de las proporciones múltiples tendría pleno sentido.
Cuando Dalton expuso en 1803 su nueva versión de la teoría atómica basada en las leyes de las proporciones definidas y de las proporciones múltiples, reconoció su deuda con Demócrito manteniendo el término «átomo» para las pequeñas partículas que formaban la materia.
En 1808 publicó Un Nuevo Sistema de Filosofía Química, en el que discutía con gran detalle su teoría atómica. En ese mismo año su ley de las proporciones múltiples quedó ratificada por las investigaciones de otro químico inglés, William Hyde Wollaston (1766-1828). A partir de entonces Wollaston prestó el apoyo de su influencia a la teoría atómica, y con el tiempo la opinión de Dalton ganó una aceptación general.
De este modo, la teoría atómica fue un golpe mortal (si es que hacía falta alguno) a la creencia en la posibilidad de la transmutación en términos alquímicos. Toda la evidencia parecía apuntar hacia la posibilidad de que cada uno de los diferentes metales constase de un tipo distinto de átomos. Toda vez que los átomos se consideraban generalmente como indivisibles e invariables (ver, sin embargo, la hipótesis de Prout en este mismo capítulo), no cabía pensar en transformar un átomo de plomo en otro de oro bajo ninguna circunstancia. El plomo, por lo tanto, no podría transmutarse en oro[12].
Los átomos de Dalton eran, claro está, demasiado pequeños como para verse, incluso al microscopio; la observación directa era impensable. Sin embargo, las medidas indirectas podían aportar información sobre sus pesos relativos.
Por ejemplo, una parte (en peso) de hidrógeno se combinaba con ocho partes de oxígeno para formar agua. Si se suponía que una molécula de agua constaba de un átomo de hidrógeno y un átomo de oxígeno, entonces podía deducirse que el átomo de oxígeno era ocho veces más pesado que el átomo de hidrógeno. Si se decide tomar el peso del átomo de hidrógeno arbitrariamente igual a 1, entonces el peso del átomo de oxígeno en esta escala sería 8.
Por otra parte, si una parte de hidrógeno se combina con cinco partes de nitrógeno para formar amoniaco, y si se supone que la molécula de amoniaco está formada de un átomo de hidrógeno y otro de nitrógeno, puede deducirse que el átomo de nitrógeno tiene un peso de 5.
Razonando de este modo, Dalton confeccionó la primera tabla de pesos atómicos. Esta tabla, aunque quizá sea su más importante contribución individual, resultó estar bastante equivocada en muchos puntos. El principal fallo reside en la insistencia de Dalton en que las moléculas estaban formadas por el apareamiento de un solo átomo de un elemento con un solo átomo de otro. Sólo se apartó de esta posición cuando era absolutamente necesario.
Con el tiempo se vio, sin embargo, que esa combinación uno-a-uno no era necesariamente el caso más frecuente. El desacuerdo se manifestó concretamente en relación con el agua, incluso antes de que Dalton hubiese propuesto su teoría atómica.
Aquí, por vez primera, la fuerza de la electricidad invadió el mundo de la química.
El conocimiento de la electricidad data de los antiguos griegos, quienes hallaron que el ámbar, al frotarlo, adquiere el poder de atraer objetos ligeros.
Siglos después, el físico inglés William Gilbert (1540-1603) fue capaz de demostrar que no es solamente el ámbar el que se comporta así, sino que también otras sustancias adquieren poder de atracción al frotarlas. Hacia 1600 sugirió que las sustancias de este tipo se llamasen «eléctricas», de la palabra que en griego significa ámbar. En consecuencia, una sustancia que adquiere tal poder, por frotamiento o de otra manera, se dice que lleva una carga eléctrica o que contiene electricidad.
El químico francés Charles François de Cisternay du Fay (1698-1739) descubrió en 1733 que había dos tipos de carga eléctrica: una que surgía en el vidrio («electricidad vítrea») y otra que podía crearse en el ámbar («electricidad resinosa»). Las sustancias que portaban un tipo de carga atraían a las de tipo contrario, mientras que dos sustancias que llevasen el mismo tipo de carga se repelían entre sí.
Benjamín Franklin (1706-90), que fue el primer gran científico norteamericano, así como gran estadista y diplomático, sugirió en 1740 la existencia de un solo fluido eléctrico. Cuando una sustancia contenía una cantidad de fluido eléctrico mayor que la normal, poseía uno de los dos tipos de carga; cuando contenía menos cantidad que la normal, poseía el otro tipo.
Franklin supuso que era el vidrio el que tenía una cantidad de fluido eléctrico superior al normal, de modo que le asignó una carga positiva. La resina, según él, llevaba una carga negativa. Los términos de Franklin se vienen utilizando desde entonces, si bien su uso lleva a un concepto de flujo de corriente opuesto al que ahora se sabe que ocurre de hecho.
El físico italiano Alessandro Volta (1745-1827) avanzó un paso más. En 1800 halló que dos metales (separados por soluciones capaces de conducir una carga eléctrica) podían disponerse de modo que una nueva carga se crease tan pronto como la vieja se alejase a lo largo de un alambre conductor. De este modo inventó la primera batería eléctrica y produjo una corriente eléctrica.
La corriente eléctrica se mantenía gracias a la reacción química que implicaba a los dos metales y a la solución intermedia. El trabajo de Volta fue la primera indicación clara de que las reacciones químicas tenían algo que ver con la electricidad, una sugerencia que no fue totalmente desarrollada hasta el siglo siguiente. Si una reacción química puede producir una corriente eléctrica, no parecía demasiado descabellado el suponer que una corriente eléctrica podría implicar lo contrario y provocar una reacción química.
De hecho, a las seis semanas de describir Volta su trabajo, dos químicos ingleses, William Nicholson (1753-1815) y Anthony Carlisle (1768-1840), demostraron la acción contraria. Hicieron pasar una corriente eléctrica a través del agua y hallaron que empezaban a aparecer burbujas de gas en las varillas de metal conductoras que habían introducido en el agua. El gas que aparecía en una varilla era hidrógeno y el que aparecía en la otra oxígeno.
En efecto, Nicholson y Carlisle habían descompuesto el agua en hidrógeno y oxígeno; tal descomposición por una corriente eléctrica se llama electrólisis. Habían realizado el experimento inverso al de Cavendish (véase cap. 4), en el que el hidrógeno y el oxígeno se combinaban para formar agua.
Al recoger el hidrógeno y el oxígeno en tubos separados a medida que burbujeaban, resultó que se había formado un volumen de hidrógeno justamente doble que de oxígeno. El hidrógeno era el más ligero en peso, con toda seguridad, pero el mayor volumen indicaba que podía haber más átomos de hidrógeno que de oxígeno en la molécula de agua.
Como el volumen de hidrógeno era justo doble que el de oxígeno, resultaba razonable suponer que cada molécula de agua contenía dos átomos de hidrógeno y uno de oxígeno, en vez de uno de cada, como propusiera Dalton.
Pero aun así, seguía siendo cierto que 1 parte de hidrógeno (en peso) se combinaba con 8 partes de oxígeno. Se dedujo entonces que un átomo de oxígeno era ocho veces más pesado que dos de hidrógeno juntos, y por tanto dieciséis veces más pesado que un solo átomo de hidrógeno. Si el peso del hidrógeno se considera 1, entonces el peso atómico del oxígeno debería ser 16, no 8.
Hipótesis de Avogadro
Los hallazgos de Nicholson y Carlisle se vieron reforzados por el trabajo de un químico francés, Joseph Louis Gay-Lussac (1778-1850), que invirtió los argumentos. Descubrió que 2 volúmenes de hidrógeno combinaban con 1 volumen de oxígeno para dar agua. Llegó a averiguar, de hecho, que cuando los gases se combinan entre sí para formar compuestos, siempre lo hacen en la proporción de números enteros pequeños. Gay-Lussac dio a conocer esta ley de los volúmenes de combinación en 1808.
Esta proporción de números enteros en la formación del agua con hidrógeno y oxígeno parecía de nuevo indicar que la molécula de agua estaba compuesta de dos átomos de hidrógeno y uno de oxígeno. También podía argüirse, siguiendo líneas de razonamiento similares, que las moléculas de amoniaco no procedían de la combinación de un átomo de hidrógeno y otro de nitrógeno, sino de un átomo de nitrógeno y tres átomos de hidrógeno. Partiendo de esta evidencia podía concluirse que el peso atómico del nitrógeno no era aproximadamente 5, sino 14.
Consideremos a continuación el hidrógeno y el cloro. Estos dos gases se combinan para formar un tercero, el cloruro de hidrógeno. Un volumen de hidrógeno se combina con un volumen de cloro, y parece razonable suponer que la molécula de cloruro de hidrógeno está formada por la combinación de un átomo de hidrógeno con uno de cloro.
Supongamos ahora que el gas hidrógeno consta de átomos de hidrógeno aislados y muy separados unos de otros, y que el gas cloro consta de átomos de cloro, también muy separados. Estos átomos se aparean para formar las moléculas de cloruro de hidrógeno, muy alejadas también unas de otras.
Vamos a suponer que empezamos con 100 átomos de hidrógeno y 100 átomos de cloruro, dando un total de 200 partículas separadas. Los átomos se aparean para formar 100 moléculas de cloruro de hidrógeno. Las 200 partículas ampliamente espaciadas (átomos) se transforman en sólo 100 partículas muy separadas (moléculas). Si el espaciado es siempre igual, hallaremos que un volumen de hidrógeno más un volumen de cloro (2 volúmenes en total) resultarían solamente en un volumen de cloruro de hidrógeno. Esto, sin embargo, no es así.
A partir de las mediciones reales, un volumen de hidrógeno combina con un volumen de cloro para formar dos volúmenes de cloruro de hidrógeno. Ya que hay dos volúmenes al empezar y dos volúmenes al acabar, debe haber el mismo número de partículas ampliamente separadas antes y después.
Pero supongamos que el gas hidrógeno no consiste en átomos separados sino en moléculas de hidrógeno, cada una formada por dos átomos, y que el cloro está compuesto de moléculas de cloro, cada una con dos átomos. En este caso, los 100 átomos de hidrógeno existirían en la forma de 50 partículas ampliamente espaciadas (moléculas), y los 100 átomos de cloro en la forma de 50 partículas separadas. Entre los dos gases hay en total 100 partículas ampliamente espaciadas, la mitad de ellas hidrógeno-hidrógeno y la otra mitad cloro-cloro.
Al combinarse, los dos gases se reagrupan para formar hidrógeno-cloro, la combinación atómica que constituye la molécula de cloruro de hidrógeno. Como hay 100 átomos de hidrógeno en total y 100 átomos de cloro, hay 100 moléculas de cloruro del hidrógeno (cada una conteniendo un átomo de cada tipo).
Ahora nos encontramos con que 50 moléculas de hidrógeno más 50 moléculas de cloro se combinan para formar 100 moléculas de cloruro de hidrógeno. Esto es compatible con lo observado en la práctica: 1 volumen de hidrógeno más 1 volumen de cloro dan 2 volúmenes de cloruro de hidrógeno.
El razonamiento anterior da por sentado que las partículas de los diferentes gases —ya estén formadas por átomos simples o por combinaciones de átomos— están en realidad igualmente separadas, como hemos venido repitiendo. En ese caso, números iguales de partículas de un gas (a una temperatura dada) darán siempre volúmenes iguales, independientemente del gas de que se trate.
El primero en apuntar la necesidad de este supuesto —en los gases, igual número de partículas ocupan volúmenes iguales— fue el químico italiano Amadeo Avogadro (1776-1856). La suposición, propuesta en 1811, se conoce por ello como hipótesis de Avogadro.
Si se tiene en cuenta esta hipótesis, es posible distinguir con claridad entre átomo de hidrógeno y moléculas de hidrógeno (un par de átomos), e igualmente entre los átomos y las moléculas de otros gases. Sin embargo, durante medio siglo después de Avogadro su hipótesis permaneció ignorada, y la distinción entre átomos y moléculas de elementos gaseosos importantes no estaba definida claramente en el pensamiento de muchos químicos, persistiendo así la incertidumbre acerca de los pesos atómicos de algunos de los elementos más importantes.
Afortunadamente, había otras claves para averiguar los pesos atómicos. En 1818, por ejemplo, un químico francés, Pierre Louis Dulong (1785-1839), y un físico francés, Alexis Thérése Petit (1791-1820), trabajando en colaboración, hallaron una de ellas. Descubrieron que el calor específico de los elementos (el aumento de temperatura que sigue a la absorción de una cantidad fija de calor) parecía variar inversamente con el peso atómico. Es decir, si el elemento x tuviera dos veces el peso atómico del elemento/, la temperatura del elemento x subiría solamente la mitad de grados que la del elemento y, después de absorber ambas la misma cantidad de calor. Esta es la ley del calor atómico.
Así, pues, basta medir el calor específico de un elemento de peso atómico desconocido para obtener inmediatamente una idea, siquiera aproximada, de dicho peso atómico. Este método funcionaba sólo para elementos sólidos, y tampoco para todos, pero era mejor que nada.
Por otra parte, un químico alemán, Eilhardt Mitscherlich (1794-1863), había descubierto hacia 1819 que los compuestos de composición semejante tienden a cristalizar juntos, como si las moléculas de uno se entremezclasen con las moléculas, de configuración semejante, del otro.
De esta ley del isomorfismo se dedujo que si dos compuestos cristalizan juntos y se conoce la estructura de uno de ellos, la estructura del segundo puede suponerse similar. Esta propiedad de los cristales isomorfos permitió a los experimentadores corregir errores que pudieran surgir de la consideración de los pesos de combinación solamente, y sirvió como guía para la corrección de los pesos atómicos.
Pesos y símbolos
El punto decisivo llegó con el químico sueco Jons Jakob Berzelius. Fue, después del mismo Dalton, el principal responsable del establecimiento de la teoría atómica. Hacia 1807, Berzelius se lanzó a determinar la constitución elemental exacta de distintos compuestos. Mediante cientos de análisis, proporcionó tantos ejemplos de la ley de las proporciones definidas que el mundo de la química no podría dudar más de su validez y tuvo que aceptar, más o menos gustosamente, la teoría atómica que había nacido directamente de dicha ley.
Berzelius empezó entonces a determinar los pesos atómicos con métodos más avanzados que los que Dalton había sido capaz de emplear. En este proyecto, Berzelius hizo uso de los hallazgos de Dulong y Petit y de Mitscherlich, así como de la ley de los volúmenes de combinación de Gay-Lussac. (No utilizó, sin embargo, la hipótesis de Avogadro). La primera tabla de pesos atómicos de Berzelius, publicada en 1828, puede confrontarse favorablemente con los valores aceptados hoy día, excepto en dos o tres elementos.
Una diferencia importante entre la tabla de Berzelius y la de Dalton fue que los valores de Berzelius no eran, por lo general, números enteros.
Los valores de Dalton, basados sobre la consideración del peso atómico del hidrógeno como 1, eran todos enteros. Esto condujo al químico inglés William Prout (1785-1850) a sugerir, en 1815, que todos los elementos estaban en definitiva compuestos de hidrógeno (sugerencia que hizo en un principio anónimamente). Según él, los diversos elementos tenían distintos pesos porque estaban compuestos de diferente número de átomos de hidrógeno aglutinados. Esto llegó a llamarse la hipótesis de Prout.
La tabla de Berzelius pareció acabar con esta atractiva hipótesis (atractiva porque reducía el creciente número de elementos a una sustancia fundamental, a la manera de los griegos, y parecía así incrementar el orden y la simetría del universo). Sobre una base de hidrógeno-igual-a-1, el peso atómico del oxígeno era aproximadamente igual a 15,9, y difícilmente podría visualizarse al oxígeno como formado por quince átomos de hidrógeno más nueve décimas partes de otro átomo de hidrógeno.
Durante el siglo siguiente se publicaron cada vez mejores tablas de pesos atómicos, y el descubrimiento de Berzelius de que los pesos atómicos de los distintos elementos no son múltiplos enteros del peso atómico del hidrógeno resultó cada vez más claro.
En la década de 1860, por ejemplo, el químico belga Jean Servais Stas (1813-91) determinó los pesos atómicos con más exactitud que Berzelius. Más tarde, a comienzos del siglo XX, el químico americano Theodore William Richards (1869-1928), tomando fantásticas precauciones, encontró valores que podrían representar la última aproximación posible por métodos puramente químicos.
Si el trabajo de Berzelius había dejado planteadas algunas dudas, el de Stas y Richards no. Los valores no enteros de los pesos atómicos simplemente habían de ser aceptados, y la hipótesis de Prout parecía morir un poco más a cada golpe. Sin embargo, no había Richards terminado de completar sus exactísimos resultados cuando la cuestión volvió a plantearse en toda su amplitud. Había que revisar de nuevo todo el significado de los pesos atómicos, y la hipótesis de Prout renació de sus cenizas, como veremos más adelante.
El hecho de que los diferentes pesos atómicos no estuviesen relacionados de un modo simple puso sobre el tapete la cuestión del patrón adecuado con el que medir los pesos. Parecía lógico asignar al hidrógeno un peso atómico igual a 1, y tanto Dalton como Berzelius lo probaron. Pero este patrón daba una vez más al oxígeno el irregular e inconveniente peso atómico de 15,9. Después de todo, era el oxígeno el que se usaba para determinar las proporciones en que se combinaban los diferentes elementos, ya que se combinaba fácilmente con muchos de ellos.
Para dar al oxígeno un peso atómico conveniente, con una interferencia mínima con el patrón hidrógeno = 1, su peso se transformó de 15,9 en 16,0000. Sobre este patrón oxígeno = 16, el peso atómico del hidrógeno era aproximadamente igual a 1,008. El patrón oxígeno = 16 se mantuvo hasta mediados del siglo XX, en que se aceptó uno más lógico, realizando muy ligeros cambios en el peso atómico (véase cap.13).
Una vez aceptada la teoría atómica podían representarse las sustancias como compuestas de moléculas con un número fijo de átomos de diferentes elementos. Parecía muy natural intentar representar tales moléculas dibujando el número conveniente de pequeños círculos y simbolizar cada tipo de átomo por un tipo específico de círculo.
Dalton ensayó este simbolismo. Representó el átomo de oxígeno mediante un círculo simple; un círculo con un punto central era un átomo de hidrógeno; con una línea vertical un átomo de nitrógeno; un círculo negro un átomo de carbono, y así sucesivamente. Pero como resultaba difícil inventar círculos suficientemente diferentes para cada elemento, Dalton dejó algunos indicados con una letra apropiada. Así, el azufre era un círculo conteniendo una S, el fósforo uno que tenía una P, etcétera.
Berzelius vio que los círculos eran superfluos y que bastaban las iniciales solas. Sugirió, por tanto, que cada elemento tuviese un símbolo válido tanto para representar el elemento en general como para un átomo del elemento, y que este nombre consistiese en principio en la inicial del nombre latino del elemento. Si dos o más elementos poseían la misma inicial, podía añadirse una de las letras siguientes del nombre. Así se constituyeron los símbolos químicos de los elementos, y hoy día hay consenso sobre ellos y son aceptados internacionalmente.
Los símbolos químicos del carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre son C, H, O, N, P y S, respectivamente. Los símbolos químicos del calcio y cloro (con preferencia del carbono sobre la mayúscula única) son Ca y Cl, respectivamente. Los símbolos son menos obvios cuando los nombres latinos difieren de los castellanos. Así, los símbolos químicos de la plata, el mercurio y el sodio son Ag («argentum»), Hg («hidrargirium») y Na («natrium»), respectivamente.
Es fácil utilizar estos símbolos para indicar el número de átomos en una molécula. Si la molécula de hidrógeno está formada por dos átomos de hidrógeno, es H2. Si la molécula de agua contiene dos átomos de hidrógeno y uno de oxígeno, es H2O (los símbolos sin número representan un solo átomo). El dióxido de carbono es CO2 y el ácido sulfúrico SO4H2, mientras que el cloruro de hidrógeno es ClH. Las fórmulas químicas de estos compuestos sencillos se explican por sí mismas.
Las fórmulas químicas pueden combinarse para formar ecuaciones químicas y describir una reacción. Si queremos expresar el hecho de que el carbono se combina con el oxígeno para formar dióxido de carbono, podemos escribir: C + O2 → CO2.
Tales ecuaciones deben cuidar de que la ley de conservación de masas de Lavoisier se cumpla para todos los átomos. Por ejemplo, en la ecuación antes citada se empieza con un átomo de C (carbono) y dos átomos de O (la molécula de oxígeno) y se acaba con un átomo de C y dos átomos de O (la molécula de dióxido de carbono).
Pero supongamos que se quiere expresar que el hidrógeno se combina con el cloro para formar cloruro de hidrógeno. Si escribimos sencillamente H2 + Cl2 → HCl, podría deducirse que hay dos átomos de hidrógeno y dos de cloro al empezar, pero solamente uno de cada al final. Para escribir una ecuación química ajustada, debe ponerse: H2 + Cl2 → 2ClH. Del mismo modo, para describir la combinación del hidrógeno y el oxígeno para formar agua, podemos formular una ecuación ajustada: 2H2 + O2 → 2H2O.
Electrólisis
Mientras tanto, la corriente eléctrica, que había sido utilizada con tan buen resultado por Nicholson y Carlisle, produjo resultados aún más espectaculares en el aislamiento de algunos nuevos elementos.
Desde la definición de «elemento» dada por Boyle siglo y medio antes (véase cap. 3) fueron descubiertas cantidades asombrosas de sustancias calificadas como elementos según esa definición. Y, lo que era más frustrante, se conocían algunas sustancias que no eran elementos, pero que contenían elementos no descubiertos que los químicos no podían estudiar aisladamente.
Los elementos se encuentran frecuentemente en combinación con oxígeno (como óxidos). Para liberar el elemento era necesario eliminar el oxígeno. Si se introdujese un segundo elemento con una afinidad más fuerte por el oxígeno, quizá éste abandonase el primer elemento para unirse al segundo. Se halló que el método funcionaba, siendo el carbono el que a menudo desempeñaba este papel. Así, el mineral de hierro, que es fundamentalmente óxido de hierro, puede calentarse con coque (una forma de carbono relativamente pura). El carbono puede combinarse con el oxígeno para formar monóxido de carbono y dióxido de carbono, quedando atrás el hierro metálico.
Pero consideremos ahora la cal. Por sus propiedades, la cal parece ser también un óxido. Sin embargo, no se conoce ningún elemento que forme cal al combinarse con oxígeno, y puede concluirse que la cal es un compuesto de un elemento desconocido con oxígeno. Para aislar ese elemento desconocido cabe calentar la cal con coque; pero así no ocurre nada. El elemento desconocido se une al oxígeno tan firmemente que los átomos de carbono son impotentes para eliminar los átomos de oxígeno. Tampoco hay ningún otro compuesto que pueda liberar a la cal de su oxígeno.
A un químico inglés, Humphry Davy (1778-1829), se le ocurrió que lo que no podía separarse por compuestos químicos podría ser forzado por el extraño poder de la corriente eléctrica, que lograba escindir la molécula de agua con facilidad cuando los compuestos químicos resultaban totalmente ineficaces.
Davy procedió a construir una batería eléctrica con más de 250 placas metálicas, la más potente construida hasta el momento. Envió intensas corrientes procedentes de esta batería a través de soluciones de compuestos sospechosos de contener elementos desconocidos, pero sin resultado. Solamente obtuvo hidrógeno y oxígeno procedentes del agua.
Evidentemente, tenía que eliminar el agua. Sin embargo, cuando usó las propias sustancias sólidas, no logró hacer pasar la corriente a través de ellas. Finalmente se le ocurrió fundir los compuestos y hacer pasar la corriente a través de la sustancia fundida. Trató, por así decirlo, de obtener un líquido conductor sin usar agua.
La idea era buena. El 6 de octubre de 1807, Davy hizo pasar una corriente a través de potasa fundida (carbonato potásico) y liberó pequeños glóbulos de un metal que inmediatamente llamó potasio. (Era tan activo que liberaba al oxígeno del agua desprendiendo hidrógeno con energía suficiente como para provocar su combustión con llama). Una semana después, Davy aisló sodio del carbonato sódico, un elemento un poco menos activo que el potasio.
En 1808, utilizando una modificación del método sugerido por Berzelius, Davy aisló varios metales de sus óxidos: magnesio de la magnesia, estroncio de la estroncianita, bario de la baritina y calcio de la cal.
Entre otras cosas, Davy también mostró que un cierto gas verdoso, que Scheele (véase cap. 4) había descubierto en la generación anterior y había pensado que era un óxido, era en realidad un elemento. Davy sugirió el nombre de cloro, del vocablo griego «verde». Davy también demostró que el ácido clorhídrico, aunque era un ácido fuerte, no contenía ningún átomo de oxígeno en su molécula, desestimando la sugerencia de Lavoisier de que el oxígeno era un componente necesario de los ácidos (véase cap. 4).
El trabajo de Davy sobre la electrólisis fue ampliado por su ayudante y protegido Michael Faraday (1791-1867), quien llegó a superar en valía científica a su maestro. Faraday, trabajando en electroquímica, introdujo una serie de términos que se utilizan todavía en la actualidad (ver fig. 10). Fue, por ejemplo, quien propuso el nombre de electrólisis para la ruptura de moléculas por una corriente eléctrica. A sugerencia del erudito inglés William Whewell (1794-1866), Faraday llamó electrolitos a los compuestos o soluciones capaces de transportar una corriente eléctrica. Las placas o varillas de metal introducidas en la sustancia fundida o solución recibieron el nombre de electrodos; el electrodo que llevaba una carga positiva era el ánodo, el que llevaba una carga negativa era el cátodo.
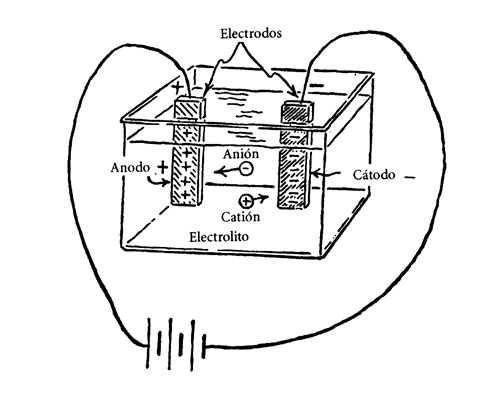
Fig. 10. La acción electrolítica fue explicada por Faraday según la línea sugerida en este dibujo esquemático. Los letreros expresan la nomenclatura que él inventó.
La corriente eléctrica era transportada a través del material fundido o la solución por entidades que Faraday denominó iones (de la palabra griega que significa «viajero»). Los iones que viajaban al ánodo eran aniones; los que viajaban al cátodo eran cationes.
En 1832 pudo proclamar la existencia de ciertas relaciones cuantitativas en electroquímica. Su primera ley de la electrólisis estableció que la masa de sustancia liberada en un electrodo durante la electrólisis es proporcional a la cantidad de electricidad que se hace pasar a través de la solución. Su segunda ley de la electrólisis afirma que el peso de metal liberado por una cantidad dada de electricidad es proporcional al peso equivalente del metal.
Así, si con una cantidad determinada de oxígeno puede combinarse 2,7 veces más plata que potasio, para una cantidad dada de electricidad se liberará de sus compuestos 2,7 veces más plata que potasio.
Las leyes de la electricidad de Faraday parecían indicar, según la opinión de algunos químicos, que la electricidad podía subdividirse en pequeñas unidades definidas, igual que la materia. En otras palabras, había «átomos de electricidad».
Supongamos que cuando la electricidad pasa a través de una solución los átomos de la materia son arrastrados, bien hacia el cátodo, bien hacia el ánodo, por «átomos de electricidad». Y supongamos también que en la mayor parte de los casos un «átomo de electricidad» baste para manejar un átomo de materia, pero que a veces hagan falta dos y hasta tres «átomos de electricidad». En ese caso, las leyes de Faraday podrían explicarse fácilmente.
Aún no había terminado el siglo XIX cuando quedó establecida esta opinión, y los «átomos de electricidad» fueron localizados. El mismo Faraday, sin embargo, nunca fue un entusiasta de los «átomos de electricidad» ni, ciertamente, del atomismo en general.